Invloed van Mg-doping op ZnO-nanodeeltjes voor verbeterde fotokatalytische evaluatie en antibacteriële analyse
Abstract
In dit onderzoek werd een gemakkelijke co-precipitatiemethode gebruikt om zuivere en Mg-gedoteerde ZnO-nanodeeltjes (NP's) te synthetiseren. De structuur, morfologie, chemische samenstelling en optische en antibacteriële activiteit van de gesynthetiseerde nanodeeltjes (NP's) werden bestudeerd met betrekking tot zuivere en Mg-gedoteerde ZnO-concentraties (0-7,5 molair (M) %). Röntgendiffractiepatroon bevestigde de aanwezigheid van kristallijne, hexagonale wurtzietfase van ZnO. Scanning-elektronenmicroscoop (SEM) -afbeeldingen onthulden dat pure en met Mg gedoteerde ZnO NP's zich in het nanoschaalregime bevonden met hexagonale kristallijne morfologie rond 30-110 nm. Optische karakterisering van het monster onthulde dat de bandgap-energie (E g ) afgenomen van 3,36 naar 3,04 eV met een toename van Mg 2+ dopingconcentratie. Optisch absorptiespectrum van ZnO roodverschoven als de Mg-concentratie varieerde van 2,5 tot 7,5 M. Fotoluminescentie (PL) spectra vertoonden UV-emissiepiek rond 400 nm. Verbeterde zichtbare emissie tussen 430 en 600 nm met Mg 2+ doping gaf de defectdichtheid in ZnO aan door Zn 2+ . te bezetten vacatures bij Mg 2+ ionen. Fotokatalytische studies onthulden dat 7,5% Mg-gedoteerde ZnO NP's maximale afbraak (78%) vertoonden voor Rhodamine B (RhB) -kleurstof onder UV-Vis-straling. Antibacteriële onderzoeken werden uitgevoerd met Gram-positieve en Gram-negatieve bacteriën. De resultaten toonden aan dat doping met Mg-ionen in de ZnO-matrix de antibacteriële activiteit tegen alle soorten bacteriën had verbeterd en dat de prestaties ervan werden verbeterd met opeenvolgende toename van de Mg-ionenconcentratie in ZnO NP's.
Achtergrond
Nanodeeltjes vertonen nieuwe eigenschappen die afhankelijk zijn van hun grootte, vorm en morfologie, waardoor ze kunnen interageren met planten, dieren en microben [1]. Nanodeeltjes van commercieel belang worden direct gesynthetiseerd uit metaal of metaalzouten, in aanwezigheid van organisch materiaal of plantenextract. De klimplanten en vele andere planten ademen een organisch materiaal uit, waarschijnlijk een polysacharide met wat hars, dat planten helpt om verticaal of door adventiefwortels te klimmen om nanodeeltjes van de aanwezige sporenelementen te produceren, zodat ze kunnen worden opgenomen [2]. Anorganische verbindingen van nanoformaat hebben een opmerkelijke antibacteriële activiteit laten zien bij zeer lage concentraties vanwege hun hoge oppervlakte-tot-volumeverhouding en unieke chemische en fysieke kenmerken [3]. Daarnaast zijn deze deeltjes ook stabieler bij hoge temperatuur en druk [4]. Sommige worden erkend als niet-toxisch en bevatten zelfs minerale elementen die essentieel zijn voor het menselijk lichaam [5]. Er is gemeld dat de meest antibacteriële anorganische materialen metalen nanodeeltjes en metaaloxide nanodeeltjes zijn zoals zilver, goud, koper, titaniumoxide en zinkoxide [6, 7]. Zink is een essentieel sporenelement voor het menselijk systeem, zonder welke veel enzymen zoals koolzuuranhydrase, carboxypeptidase en alcoholdehydrogenase inactief worden, terwijl de andere twee leden, cadmium en kwik die tot dezelfde groep elementen met dezelfde elektronische configuratie behoren, giftig [8]. Voor de biosynthese van nanodeeltjes worden verschillende delen van een plant gebruikt omdat ze metabolieten bevatten zoals alkaloïden, flavonoïden, fenolen, terpenoïden, alcoholen, suikers en eiwitten die werken als reductiemiddelen om nanodeeltjes te produceren. Ze fungeren ook als afdekmiddel en stabilisator voor hen. Ze worden gebruikt in de geneeskunde, landbouw en vele andere gebieden, evenals technologieën. De aandacht gaat daarom uit naar alle plantensoorten die geur of kleur in hun bladeren, bloemen of wortels hebben voor de synthese van nanodeeltjes, omdat ze allemaal chemicaliën bevatten die de metaalionen reduceren tot metalen nanodeeltjes [9]. Onlangs zijn nanodeeltjes in de belangstelling komen te staan vanwege hun unieke mechanische, optische, magnetische, elektrische en andere eigenschappen [10]. Deze opkomende kenmerken maken ze een veelbelovende kandidaat voor gebruik in elektronica, medicijnen en andere gebieden. Er is waargenomen dat nanomaterialen een grotere oppervlakte-tot-volumeverhouding hebben in vergelijking met hun conventionele vormen [11]. Dit is de reden waarom nanomaterialen een grotere chemische reactiviteit vertonen. Kortom, op nanoschaal is het kwantumeffect meer uitgesproken om hun eindkenmerken te bepalen, wat leidt tot nieuw optisch, magnetisch en elektrisch gedrag. Van de verschillende nanostructuren van metaaloxidehalfgeleiders hebben ZnO-nanostructuren veel belangstelling getrokken vanwege hun lage kosten, hoge chemische stabiliteit en massaproductie [12]. ZnO-onderzoek vormt slechts een redelijk deel van de huidige nano-look in; echter, alle factoren in aanmerking genomen, is het een van de belangrijke materialen die een groeiend deel van de nanotechnologie zonder grenzen zal veronderstellen. ZnO is een van de meest algemeen aangesloten actuele medicijnen ooit. Het wordt gebruikt in de meeste zonnebrandmiddelen en vindt zijn weg naar tal van behandelingen voor het verlichten van angst en jeuk [13]. Het zal worden gezien op de functie van fotokatalyse, hoofdzakelijk op ZnO en gedoteerd ZnO; er is een groot aantal potentiële chemische, fotochemische en elektrochemische reacties die kunnen optreden op het oppervlak van de fotokatalysator [14]. ZnO heeft veel aandacht gekregen bij de afbraak en totale mineralisatie van milieuverontreinigingen [15]. Het meest geprefereerde gezichtspunt van ZnO is het vermogen om een uitgebreide variëteit aan op zonne-energie aangedreven lichtbereik en meer lichtquanta aan te trekken dan sommige halfgeleidende metaaloxiden. ZnO heeft zich ontwikkeld als het belangrijkste materiaal en een bekwame en veelbelovende kandidaat in de beheerstructuur van groene ecologie vanwege zijn nieuwe eigenschappen [16].
In principe zijn twee factoren, namelijk oppervlakte en oppervlaktedefecten, de belangrijkste variabelen om de fotokatalytische activiteit van halfgeleidermetaaloxiden te bepalen. Vanwege de hoge oppervlakteactiviteit, kristallijne aard, morfologische kenmerken en textuur; ZnO-nanodeeltjes worden beschouwd als de meest gunstige katalysator voor de afbraak van organische verontreinigende stoffen [17]. Recente literatuur meldde dat Mg-gedoteerde ZnO-nanostructuren uitstekende eigenschappen kunnen vertonen voor apparaattoepassing [18]. Onderzoek naar dotering van Groep II-elementen met ZnO toonde aan dat de doteermiddelen de bandgap-energie kunnen veranderen (E g ) met een toename van de UV-zichtbare luminescentie-intensiteit [19].
Doping van Mg in ZnO zal naar verwachting de absorptie, fysische en chemische eigenschappen van ZnO wijzigen [20]. Met metaalionen gedoteerde ZnO-nanostructuren zijn de meest veelbelovende katalysator voor de afbraak van verschillende verontreinigende stoffen vanwege de verbetering van de optische eigenschappen [21]. Verschillende soorten infectieziekten veroorzaakt door bacteriën vormen wereldwijd een ernstige bedreiging voor de volksgezondheid. Om de antibacteriële activiteit van ZnO te verbeteren, moeten verschillende soorten fysiochemische eigenschappen, zoals deeltjesgrootte, kristalliniteitsindex en optische eigenschappen, worden gewijzigd door doping met metaal of niet-metaal [22].
Door meer defecten over het oppervlak van ZnO te induceren, kunnen de optische adsorptie-eigenschappen worden verbeterd. In wezen zijn minieme hoeveelheden doteermiddelen voldoende om als donoren of acceptoren in het halfgeleiderkristalrooster te werken, wat de eigenschappen van de halfgeleider aanzienlijk en in grotere mate zal veranderen. De groottekwantisatie zorgt voor variatie in de energiekloof tussen de geleidingsbandelektronen en valentiebandgaten die resulteren in verandering in optische eigenschappen van de gedoteerde metaaloxidenanostructuren [23]. Eerdere literatuur meldde dat ZnO-nanodeeltjes bestand zijn tegen bacteriën en dat ze het vermogen hebben om ultraviolette straling af te schermen [24]. Zinkoxide NP's hebben het vermogen om de gramnegatieve celmembraanstructuur van Escherichia coli te verstoren [25, 26]. Er werd ook gemeld dat nanodeeltjes met een positieve lading het gramnegatieve celmembraan zouden kunnen binden door middel van elektrostatische aantrekking [27]. ZnO NP's gedoteerd met verschillende metaalionen werden geëvalueerd tegen E. coli , en Staphylococcus aureus toonde aan dat de antibacteriële activiteit toenam met de kristallietgrootte [28]. Verschillende fysische en chemische technieken zijn door onderzoekers toegepast om zuivere en gedoteerde ZnO NP's te synthetiseren, zoals het damptransportproces [29], spraypyrolyse [30], thermische ontleding [31], elektrochemische methode [32], sol-gel methode [33], hydrolyse [34], chemische precipitatie [35] en hydrothermische methode [36] om de morfologie en grootte aan te passen. Van al deze methoden is de co-precipitatiemethode relatief eenvoudig en goedkoop. Bovendien kan het een hoge opbrengst geven bij kamertemperatuur voor de synthese van zuivere en gedoteerde ZnO NP's [37].
Hier hebben we de voorbereiding en karakterisering van ZnO-nanodeeltjes met verschillende concentraties Mg-doteringsmiddelen onderzocht met behulp van een eenvoudige chemische co-precipitatiemethode. De effecten van Mg 2+ ionenconcentratie in het ZnO-rooster zijn geëvalueerd in termen van structurele, morfologische, optische en fotokatalytische studies. Verder het effect van Mg 2+ ionen op de antibacteriële activiteit werden bestudeerd tegen (Gram-positieve en Gram-negatieve) S. aureus , E. coli , en Proteus culturen.
Methoden
Alle reagentia van analytische kwaliteit werden gekocht bij Sigma-Aldrich en gebruikt zoals ontvangen zonder verdere zuivering. Het stroomschema (Fig. 1) beschrijft de bereidingsmethode van de zuivere en Mg-gedoteerde ZnO NP's. Bij deze methode wordt 1 M natriumhydroxide (NaOH)-oplossing toegevoegd aan 1 M zinkchloride (ZnCl2 ) oplossing. De uiteindelijke oplossing wordt gedurende 6 uur onder constant roeren gehouden. De alkalische oplossing van natriumhydroxide helpt bij het neerslaan van de overgangsmetaalhydroxiden. Het versnelt het reductieproces en veroorzaakt zo de vorming van ZnO en Mg-gedoteerde ZnO-nanodeeltjes. Verder zet natriumhydroxide ZnCl2 . om naar Zn(OH)2 die na verwarming ZnO-nanodeeltjes oplevert. Na het neerslaan wordt het bekerglas eruit gehaald en wordt voldoende tijd gegeven om het eindproduct te laten bezinken. Het verkregen product wordt gefiltreerd en meerdere malen gewassen met gedeïoniseerd water en aceton. Ten slotte worden de monsters gedurende 5 uur bij 100 ° C gedroogd en vervolgens omgezet in een fijn poeder door ze in een agaatvijzel te malen. De aldus verkregen poeders worden gedurende 4 uur bij 300 °C gecalcineerd om ZnO-deeltjes van nanogrootte op te leveren.
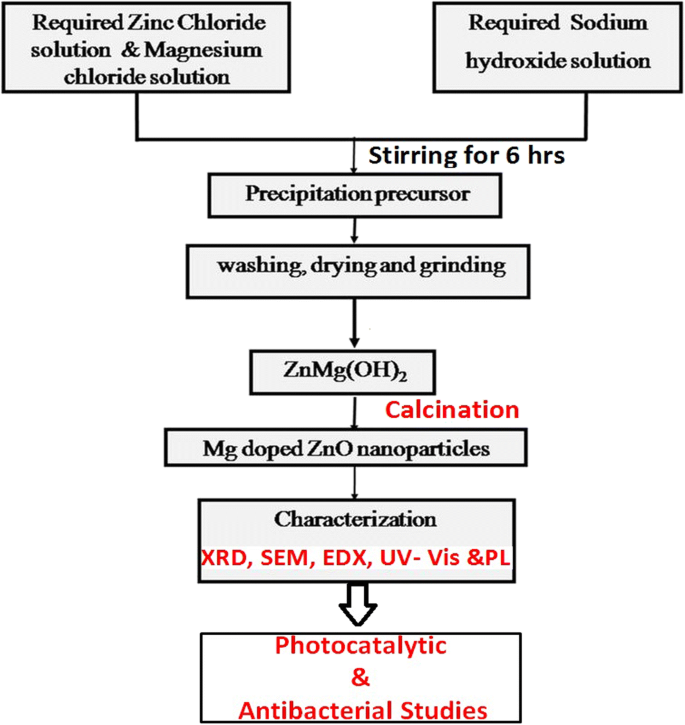
Stroomschema dat de synthese van Mg-gedoteerde ZnO NP's beschrijft
Om Mg-gedoteerde ZnO te synthetiseren, molaire verhoudingen van ZnCl2 en MgCl2 werden gemeten als Zn1 − x Mg x O (waar x = 0,025, 0,050 en 0,075) en dezelfde procedures werden herhaald. De chemische vergelijking voor de synthese van zuivere en Mg-gedoteerde ZnO worden getoond in Vgl. (1–4)
$$ {\mathrm{ZnCl}}_2+2\mathrm{NaOH}\to \mathrm{Zn}{\left(\mathrm{OH}\right)}_2+2\mathrm{NaCl}\left(\mathrm {aq}\right) $$ (1) $$ \mathrm{Zn}{\left(\mathrm{OH}\right)}_2\naar \mathrm{Sintering}\naar \mathrm{Mg}\hbox{- } \mathrm{doped}\ \mathrm{ZnO}+{\mathrm{H}}_2\mathrm{O} $$ (2) $$ {\mathrm{MgCl}}_2+{\mathrm{ZnCl}}_2+ 2\mathrm{NaOH}\to \mathrm{ZnMg}{\left(\mathrm{OH}\right)}_2+2\mathrm{NaCl}\left(\mathrm{aq}\right) $$ (3) $$ \mathrm{ZnMg}{\left(\mathrm{OH}\right)}_2\to \mathrm{Sintering}\to \mathrm{Mg}\hbox{-} \mathrm{doped}\ \mathrm{ZnO }+{\mathrm{H}}_2\mathrm{O} $$ (4)In de elektrochemische reeks is Mg reactiever dan Zn en daarom ondergaat het reductie om het Zn-rooster te bezetten.
Karakterisering
De kristalstructuren van de monsters werden onderzocht met röntgendiffractie (XRD) Bruker D8 geavanceerde röntgendiffractometer) met Cukα-straling (λ = 1,54 Å) en oppervlaktemorfologiekenmerken werden bestudeerd met veldemissie-scanning-elektronenmicroscoop (FESEM, ZEISS). Optische absorptiespectra van de monsters werden opgenomen met een dubbele bundel UV-zichtbare spectrofotometer met behulp van Hitachi U-3900H in het bereik van 200-1200 nm. Fotoluminescentie (PL) emissie-onderzoeken werden uitgevoerd met behulp van een spectrometer (JOB HR800 IN Yoon Horbe) met behulp van een He-Cd-laserbron met een golflengte van 325 nm. De antibacteriële activiteit van de gesynthetiseerde monsters werd getest op verschillende organismen door middel van agarschijfdiffusietechniek.
Meting van fotokatalytische activiteit
Experimenten werden uitgevoerd in een fotokatalytische kwartsreactor met een capaciteit van 150 ml. De reactor had voorzieningen voor watercirculatie om een constante temperatuur te garanderen. De UV-bestraling werd uitgevoerd met behulp van 125 W (311 nm) middendruk Hg-booglamp (SAIC, INDIA). Honderdvijftig milliliter gewenste beginconcentratie (20 ppm) RhB-kleurstofoplossing werd gemengd met een vaste hoeveelheid ZnO NP's (50 mg/L) bij natuurlijke pH (6,2). De oplossing werd onder UV-verlichting geplaatst en magnetisch geroerd. Het monster uit de fotoreactor werd met verschillende tijdsintervallen teruggetrokken en gecentrifugeerd. De supernatanten werden geanalyseerd op het absorptiemaximum (554 nm) met behulp van een UV-Vis-spectrofotometer. Een vergelijkbare procedure werd toegepast voor Mg-doteringsmiddelen (2,5, 5 en 7,5%) -ZnO NP's met behulp van RhB-kleurstofoplossing. Percentage RhB afgebroken door het katalysatoroppervlak werd berekend met de volgende vergelijking:
$$ \mathrm{Percentage}\ \mathrm{of}\ \mathrm{degradation}=\left({C}_0-{C}_t\right)/{C}_0\times 100\% $$ (5)waar C 0 staat voor de initiële tijd van absorptie en C t staat voor de absorptie na verschillende tijdsintervallen (0, 30, 60, 90 en 120 min).
Antibacteriële onderzoeken
E. coli (Gram-negatief), S. aureus (Grampositief), en Proteus (Gram-negatieve stammen) werden vóór gebruik op bouillonmedia op 4 ° C gehouden. Voedingsagarmedium werd bereid en gedurende 15 minuten bij 121 ° C gesteriliseerd. Vijfentwintig milliliter voedingsagar werd in steriele petrischalen gegoten en het werd toegestaan om te zetten. In elke petrischaal was 0,2 ml van verschillende bacteriesoorten (E. coli , S. aureus , en Proteus ). Er werd een schijf gemaakt en in de platen geplaatst met behulp van een steriele lus, en twee schijfjes per plaat werden in de uitgeharde agar met de bacteriecultuur gemaakt.
Resultaten en discussie
Structuurstudies
Figuur 2 illustreert de röntgendiffractie (XRD) patronen voor de zuivere en Mg-gedoteerde ZnO-monsters. In de figuur zijn zeven hoofdpieken te zien op 31,8°, 34,5°, 36,3°, 47,5°, 56,7°, 62,9° en 68°, die kunnen worden toegeschreven aan diffractie van (100), (002), (101), (102), (110), (103) en (112) vlakken respectievelijk voor een roosterconstante van a = b = 3.24 en c = 5.2066 Å [38]. Het XRD-patroon weerspiegelt duidelijk de aanwezigheid van de hexagonale wurtzietfase-kristalstructuur voor zuivere ZnO-nanodeeltjes (JCPDS:36-1451) [39]. Ook uit de diffractie blijkt dat er geen verdere secundaire fasen worden waargenomen met Mg-doteringsmiddel in het ZnO-kristalrooster en dat er geen significante veranderingen worden waargenomen in het XRD-patroon van de met Mg gedoteerde ZnO NP's. Er wordt ook opgemerkt dat de intensiteit van de XRD-piek afneemt met toename van de Mg-dopingconcentratie (getoond in Fig. 2a-d), wat het slanke verlies in hun kristalliniteit als gevolg van vervorming van het rooster bevestigt. Vanwege Mg-ionen die in het periodieke kristalrooster van ZnO doteren, wordt een kleine hoeveelheid spanning overgehaald. Dit resulteert in het verwisselen van het rooster, wat vervolgens leidt tot een verandering van de regelmaat van het kristal. Zeer zorgvuldige gevolgtrekkingen geven echter aan dat de piekpositie verschuift naar de lagere hoekwaarden zoals waargenomen bij hogere dotering van Mg in de ZnO-matrix. Vooral voor de piek die zich op (101) vlak 35°.84 bevindt, wordt gevonden dat deze naar een lagere waarde verschuift met een toename van de dopingconcentratie, wat kan worden toegeschreven aan de vervanging van Zn 2+ ionen door Mg 2+ ionen [40]. In de literatuur wordt goed gerapporteerd dat de roosterkenmerken van de gastheermaterialen worden veranderd door de opname van doteringsmaterialen. Dit gebeurt vanwege hun variantie in de atomaire stralen. Bovendien kunnen de doteringsionen Zn-ionen in het gastheerrooster (Mg-ionen) [41] vervangen. Dus de basisstructuur van ZnO NP's is ongewijzigd en ze behouden hun oorspronkelijke wurtzietstructuur. Dit geeft aan dat de meeste van de Mg 2+ ionen gaan het rooster in als substitutie-ionen om de Zn 2+ te vervangen ionen en komen niet in de lege ruimten. Aangezien de ionische straal van de gesubstitueerde Mg 2+ (R Mg 2+ = 0,057 nm is 0,57 Å) is kleiner dan die van Zn 2+ (R Zn 2+ = 0.06 nm is 0.60 Å) [42], het is waargenomen dat de verschuiving overeenkomt met een kleine hoeveelheid roosterspanning op de rekening van Mg 2+ in ZnO-omgeving.
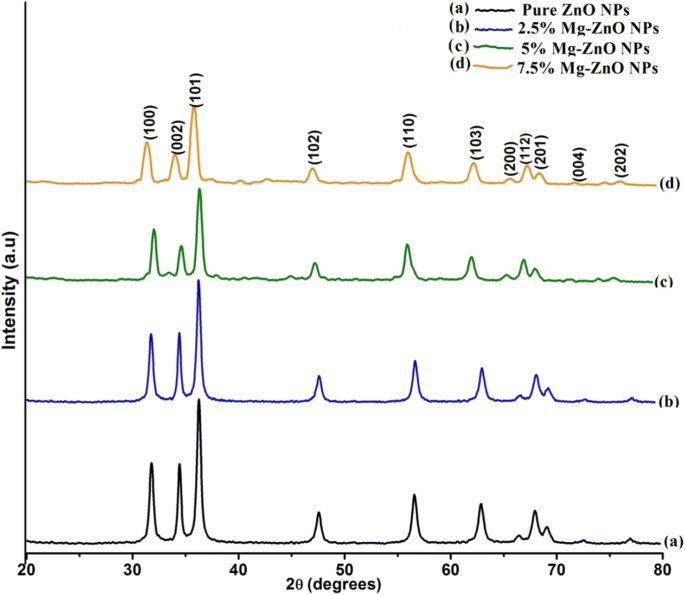
XRD-patroon voor zuivere en Mg-ZnO NP's. een Zuivere ZnO NP's. b 2,5% Mg-ZnO NP's. c 5% Mg-ZnO NP's. d 7,5% Mg-ZnO NP's
De gemiddelde kristallietgrootte wordt berekend met behulp van Scherrer-formule [43].
$$ d=\frac{0.89\lambda }{\beta \cos \theta } $$ (6)waar λ is de golflengte van de straling (1.54056 Å), β is de volledige breedte bij halve maximale intensiteit, en θ is de diffractiehoek. Uit de berekende waarden blijkt dat de gemiddelde kristallietgrootte toeneemt met een toename van de Mg-dopingconcentratie (tabel 1).
Effect van doping op roosterparameters
De kristallietgrootte, roosterparameters, atomaire pakkingsfractie (APF), roosterrek en volume tonen de fysische eigenschappen van zuivere en gedoteerde ZnO NP's [44]. Voor een wurtzietfase worden de roosterparameters berekend met behulp van de Vgl. (7–9) waarbij, a = b, en c de roosterparameters zijn, d hkl is de interplanaire afstand die overeenkomt met de Miller-indices (hkl).
$$ \frac{1}{d_{hkl}}=\frac{\left({h}^2+{k}^2\right)}{a^2}+\frac{l^2}{c ^2} $$ (7) $$ a=\frac{\lambda }{\sqrt{3\sin {\theta}_{100}}} $$ (8) $$ c=\frac{\lambda } {\sin {\theta}_{002}} $$ (9) $$ D=\frac{1}{APF} $$De berekende roosterparameters staan vermeld in Tabel 1. Uit Tabel 1 blijkt dat er een wijziging is in de roosterparameterwaarden als Mg 2+ ion vervangt Zn 2+ ion in het rooster. Naarmate de doteringsconcentratie toeneemt, neemt het opgenomen doteringsatoom de plaats van het substitutierooster in. Uit tabel 1 blijkt ook dat de kristallietgrootte (D) omgekeerd evenredig varieert met de atomaire pakkingsfractie (APF) zoals weergegeven in Vgl. (10).
Spanning geïnduceerd wordt berekend met behulp van Vgl. (10).
$$ \varepsilon ={\beta}_{hkl}\cos \theta /4 $$ (10)Verder wordt opgemerkt dat er een afname is in de roosterspanning als gevolg van Mg 2+ ionen doteren in de ZnO-matrix (tabel 1), wat de lokale vervorming van de kristalstructuur veroorzaakt. Dit is duidelijk en ook eerder opgemerkt in de literatuur vanwege het verschil in hun atomaire stralen en in hun dopingconcentratie [45].
Field Emission Scanning Electron Microscope (FESEM) en EDS-analyse
Figuur 3a-d illustreert de morfologie van Mg-gedoteerde ZnO NP's bij verschillende Mg-molaire concentraties. Uit de FESEM-afbeeldingen blijkt dat de meeste korrels in het nanoschaalregime vallen. Er wordt ook opgemerkt dat de deeltjes op hun oppervlak worden geaggregeerd. Aggregatie van deeltjes op het oppervlak kan zijn ontstaan door de hoge oppervlakte-energie van de gesynthetiseerde NP's [46]. Het is interessant om op te merken dat voor een doteringsconcentratie van 5 M% en 7,5 M% enkele hexagonale kristalvormige en goed verdeelde nanogestructureerde korrels worden waargenomen die wijzen op de invloed van hogere dotering Mg op het oppervlak van de ZnO-matrix. Met een verhoogde concentratie van Mg-ionen in de ZnO-matrix nam de korrelgrootte van de uiteindelijke deeltjes toe van 30 tot 110 nm. Figuur 3c, d is in overeenstemming met de kristallietgrootte verkregen door de XRD-analyse.

FESEM-foto's van pure en Mg-gedoteerde ZnO NP's. een Zuivere ZnO NP's. b 2,5% Mg-ZnO NP's. c 5% Mg-ZnO NP's. d 7,5% Mg-ZnO NP's
Figuur 4a-d toont de chemische samenstellingsanalyse van zuivere en Mg-gedoteerde ZnO-nanodeeltjes die zijn uitgevoerd met behulp van EDS. Uit de verkregen EDS-spectra wordt de aanwezigheid van verschillende elementen zoals Zn, Mg en O waargenomen. Figuur 4c, d laat duidelijk zien dat de intensiteit van Mg iets toeneemt met het injecteren van Mg in de ZnO-omgeving. De opname van Mg-ionen had een significant effect op de structurele en optische eigenschappen. Uit het EDS-spectrum werd ook geconcludeerd dat er geen andere vreemde elementen aanwezig waren in de gesynthetiseerde monsters.
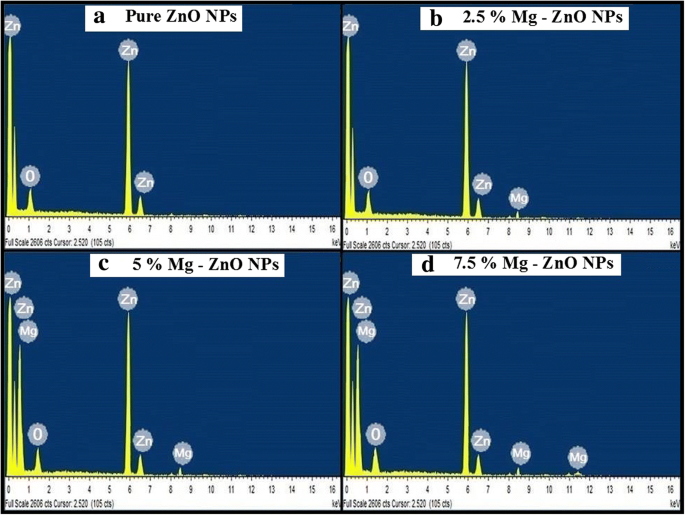
Energie-dispersieve X-ray (EDS) spectra. een Zuivere ZnO NP's. b 2,5% Mg-ZnO NP's. c 5% Mg-ZnO NP's. d 7,5% Mg-ZnO NP's
Optische studies
De UV-Vis-absorptiespectra van zuivere en met Mg gedoteerde ZnO NP's als functie van de golflengte voor het bereik van 200 tot 1200 nm worden geïllustreerd in figuur 5a. Uit de figuur blijkt dat de absorptiepiek toeneemt met de dopingconcentratie. De toename in absorptie kan te wijten zijn aan verschillende factoren, zoals deeltjesgrootte, zuurstoftekort en defecten in de korrelstructuur [47]. De sterke absorptie wordt gevonden voor de golflengte onder 380 nm voor Mg-gedoteerde ZnO-nanodeeltjes, terwijl een zeer lage absorptie wordt waargenomen in het zichtbare gebied zoals waargenomen in figuur 5a. Dit wordt toegeschreven aan een grotere absorptie van invallende fotonenergie door de moleculen die aanwezig zijn in de lagere energietoestand en opgewonden raken naar de hogere energieniveaus.
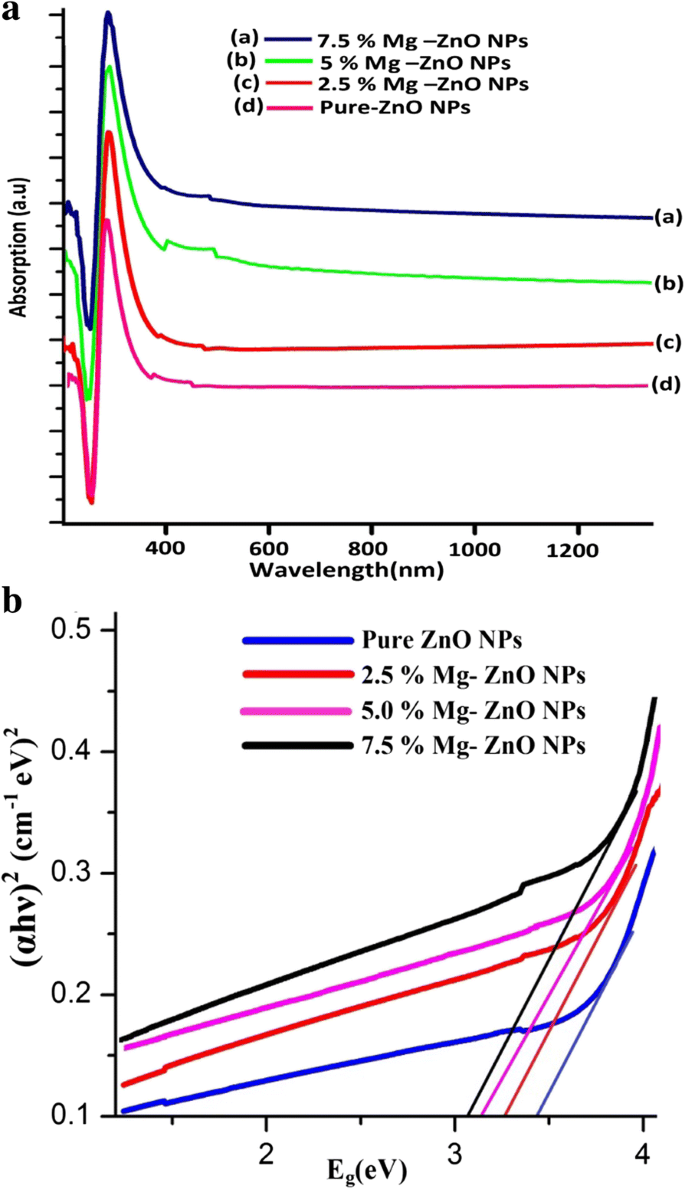
een Optische absorptie en b band gap-energie (E g ) voor zuivere en met Mg gedoteerde ZnO NP's
Er wordt waargenomen dat de absorptierand van met Mg gedoteerde ZnO NP's wordt verschoven naar de langere golflengte (roodverschuiving) wanneer het Mg-gehalte wordt gewijzigd van 2,5 tot 7,5 M%. Dit kan te wijten zijn aan de kleine hoeveelheid roosterspanning die in het monster aanwezig is als gevolg van Mg-doteringsmiddel naar ZnO. Dit roodverschuivingsgedrag zal naar verwachting afnemen in zijn band gap (E g ) waarde. De optische bandgap (E g ) wordt bepaald uit een Tauc-plot uit de volgende relatie (11).
$$ \alpha =\frac{A{\left( h\nu -{E}_{\mathrm{g}}\right)}^{1/2}}{hv} $$ (11)waar α is absorptiecoëfficiënt, h is de constante van Plank, ν is de frequentie van lichtstraling, en E g is de band gap-energie, waarbij "n ” neemt de waarde van ½ voor toegestane directe overgang [48]. Percelen van (αhν) 2 versus (hν) zijn gemaakt voor pure en Mg-gedoteerde ZnO NP's. De band gap-energie (E g ) wordt verkregen door extrapolatie van de lineaire delen van de grafieken naar de x -as.
Uit figuur 5b blijkt dat de bandgap-energie (E g ) voor zuivere ZnO NP's is ongeveer 3,36 eV en neemt af met Mg-doteringsstof (3,36 tot 3,04 eV). De band gap wordt verkleind door sterke kwantumbeperkingen en verbetering van hun oppervlakte tot volumeverhouding [49]. Verbetering van roodverschuiving en afname van bandgap-energie (E g ) bevestig de aanwezigheid van Mg 2+ in de Zn 2+ site van het ZnO-rooster.
Fotoluminescentieonderzoeken
Afbeelding 6 illustreert de fotoluminescentiespectra voor de pure en Mg 2+ -gedoteerde ZnO NP's bij de golflengte van 325 nm. Een relatief stevige UV-emissieband rond 400 nm en brede banden bij 450 tot 620 nm worden waargenomen in het zichtbare spectrumgebied. Sterke UV-emissie wordt toegeschreven aan de stralingsrecombinatie van excitonen (exciton-emissie) [50]. De oorsprong van de brede zichtbare emissieband bij 450 tot 620 nm is te wijten aan de oppervlakte-anionvacatures [51]. Dit kan te wijten zijn aan het tunnelen van oppervlaktegebonden elektronen door reeds bestaande ingesloten gaten [52]. Er wordt ook waargenomen dat de intensiteit van emissiebanden die worden waargenomen bij 390 en 525 nm afneemt met een hogere dotering van het Mg-gehalte (7,5%). Hogere dopingpercentages in de ZnO NP's verhinderen de recombinatie van door foto gegenereerde elektronen en gaten. Bovendien produceren Mg-ionen (7,5%) extra actieve defectlocaties binnen het ZnO-rooster, wat resulteert in verdere adsorptie van zichtbaar licht door deze actieve defectlocaties [53].
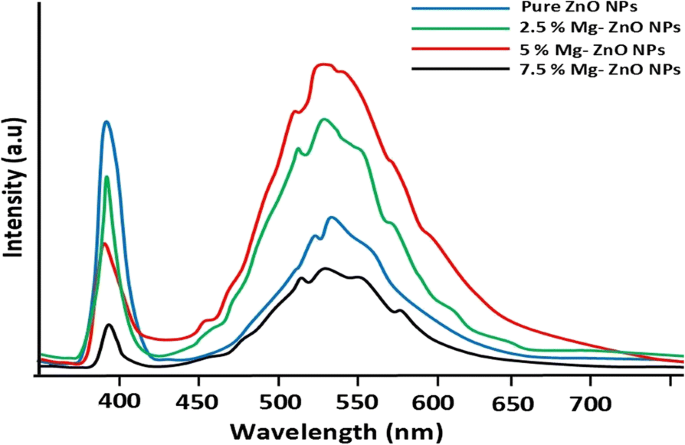
Fotoluminescentiespectrum van zuivere en Mg-ZnO NP's
Fotokatalytische onderzoeken
De fotokatalytische afbraakstudie van zuiver en met Mg gedoteerd ZnO met Rhodamine B (Rh B) kleurstofoplossing werd bestudeerd onder verschillende tijdsintervallen (0-120 min). De optische absorptiespectra van RhB-kleurstofoplossing met verschillende tijdsintervallen (0-120 min) werden geregistreerd en hetzelfde wordt geïllustreerd door Fig. 7. Er wordt waargenomen dat met het verstrijken van de tijd de piekhoogte afneemt, wat wijst op een grotere afbraak van Rhodamine B als gevolg van aan de fotokatalytische activiteit van ZnO. Een verwaarloosbare hoeveelheid van de kleurstof is afgebroken met zuiver ZnO na 120 min, terwijl het 7,5% Mg-gedoteerde monster een hogere degradatie-efficiëntie vertoonde. Dit wordt verwacht vanwege de aanwezigheid van defecten en zuurstofvacatures gecreëerd door Mg-doping in de ZnO-matrix [54]. Figuur 8 toont het percentage afbraak voor zuivere en Mg-gedoteerde ZnO NP's. Er wordt waargenomen dat 7,5% Mg-gedoteerde ZnO een maximale afbraak van 78% vertoonde in vergelijking met de andere dopingconcentraties (tabel 2). Er wordt ook opgemerkt dat een hogere Mg (10% of meer) doteringsconcentratie in ZnO de fotokatalytische activiteit zal verminderen. Dit is begrijpelijk vanwege de fysieke defecten en de verhoogde oxidatietoestanden van kationen. Dit fenomeen werd eerder in de literatuur waargenomen, waarin werd beschreven dat overtollige kationen die tijdens het doteringsproces worden geproduceerd, zullen fungeren als vangplaatsen voor de gaten en elektronen. Dit zal vervolgens de recombinatie van door foto gegenereerde geladen soorten stimuleren. Dit belemmert geleidelijk de vorming van •OH (hydroxyl) en O•2 − (zuurstof)superoxide radicalen. Dit fenomeen zal de fotokatalytische activiteit verminderen. Vergelijkbare resultaten zijn gerapporteerd door Lee et al. [55] en Yousefi et al. [56]. Verder is in onze co-precipitatietechniek de thermodynamische oplosbaarheid minder voor hogere doteringsconcentratie van Mg in ZnO. Vergelijkbaar met dergelijke resultaten zijn gerapporteerd door Javed Iqbal et al [57].
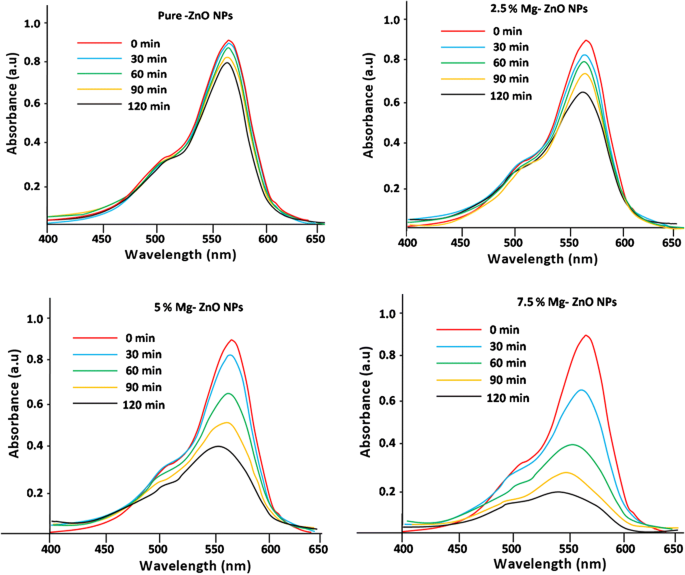
Spectrale absorptievermindering van waterige oplossing van Rhodamine B-kleurstof afgebroken van (0-120 min)
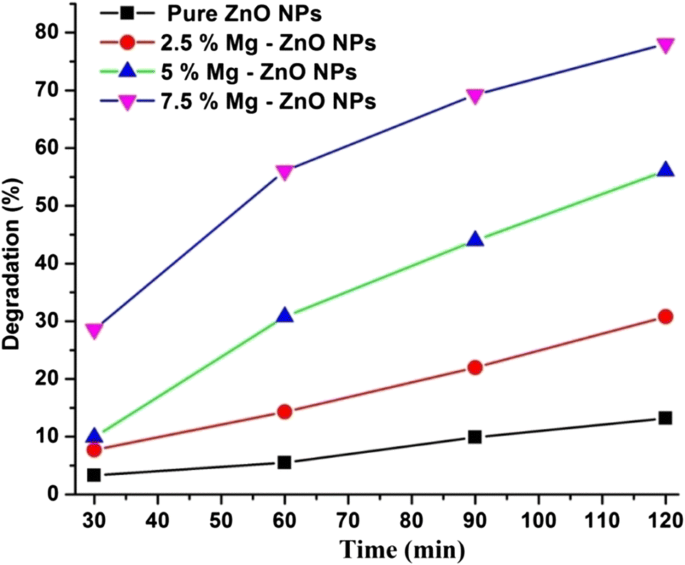
Fotodegradatie van Rhodamine B onder pure en IZ-NP's
Het lijkt erop dat met Mg gedoteerde ZnO NP's vergelijkbaar zijn met elektronenafvoer, wat bijgevolg de scheiding van de door foto gegenereerde elektron-gatparen aanzienlijk kan verbeteren en hun recombinatie kan remmen, wat resulteert in verbeterde fotokatalytische activiteit [58].
De reactiekinetiek kan worden waargenomen door lineaire curven uit te zetten voor de concentratieverhouding, ln(C/Co ), tegen de bestralingstijd “t ”. Uit de grafiek (Fig. 9a) is duidelijk zichtbaar dat het bestaan van Mg-ionen van 2,5 tot 7,5% in de ZnO-matrix in feite het fotokatalytische proces heeft geactiveerd. Uit Fig. 9b werd de RhB-degradatiesnelheidsconstante k geëvalueerd en deze was 1,09 × 10 − 3 , 2.76 × 10 − 3 , 5,72 × 10 − 3 , en 1,26 × 10 − 2 en voor de zuivere ZnO NP's, respectievelijk 2,5% Mg-ZnO NP's, 2,5% Mg-ZnO NP's en 2,5% Mg-ZnO NP's. Onder hen hebben de 7,5% Mg-ZnO NP's de hoogste degradatiesnelheidsconstante (k) -waarde vertoond, die behoorlijk aanzienlijk is toegenomen in vergelijking met die van pure ZnO NP's (tabel 2). De bevindingen van dit fotokatalytische experiment laten duidelijk zien dat de dotering van Mg-ionen tot een bepaalde limiet de fotokatalytische activiteit van de ZnO-fotokatalysator effectief kan verbeteren.
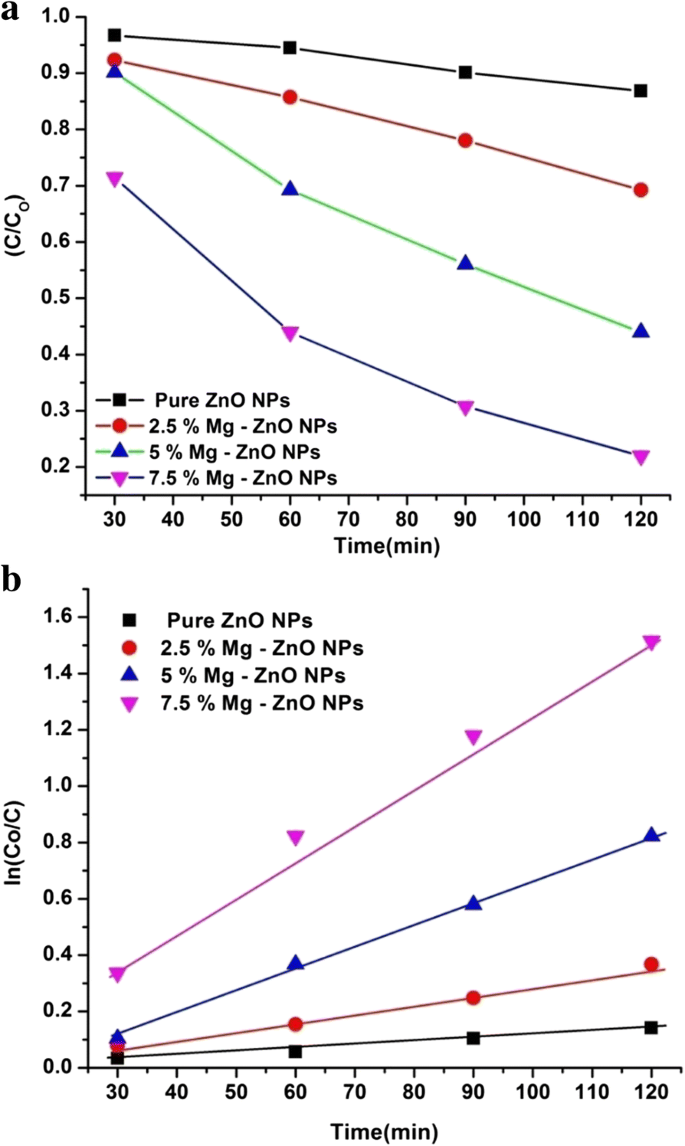
(een ) Evolutie van de relatieve concentratie van RhB als functie van de tijd voor zuivere en Mg-ZnO NP's (b ) De reactiekinetiek van RhB-kleurstofafbraak voor zuivere en Mg-ZnO NP's
De reden achter de verbeterde fotokatalytische activiteit voor met Mg gedoteerde ZnO NP's is een vergroot oppervlak met de aanwezigheid van zuurstofvacatures aan het oppervlak [59]. Het fotokatalytische mechanisme van halfgeleidermaterialen verloopt via de vorming van een elektron-gatpaar (e − , h + ) samen met de daaropvolgende scheiding en de recombinatie van elektronen en gaten [60]. Fotokatalytische activiteit voor zuiver ZnO wordt toegeschreven aan zowel de donortoestanden veroorzaakt door een groot aantal defectlocaties zoals zuurstofvacatures en interstitiële zinkatomen als de acceptortoestanden die voortkomen uit zinkvacatures en interstitiële zuurstofatomen [61]. Maar voor Mg-gedoteerde ZnO NP's voor de afbraak van RhB onder UV-zichtbare bestraling, worden aanvankelijk elektron-gatparen gecreëerd en vervolgens de soorten zoals •OH en •O − 2 worden gevormd zoals weergegeven in de vergelijking.
$$ ZnO+ h\nu \to ZnO\left({e}_{CB}+{h}_{VB}\right) $$ (12)The photo-induced electrons are easily trapped by electronic acceptors like adsorbed (O2 ), in order to produce a superoxide radical anion (O• − 2 ) Eq. (13)
$$ {e}_{CB}+{O}_2\to {O}_2^{\bullet -} $$ (13)Further, the photo-induced holes are easily trapped by negative OH − ions to errand the production of hydroxyl radical species (OH•) Eq. (14)
$$ {OH}^{-}+{h}^{+}\to {OH}^{\bullet } $$ (14)Thus produced OH − radical and superoxide radical anion will carry out the total photocatalytic reaction. However, •OH radical is a particularly strong oxidant which can cause fractional or complete mineralization of organic molecules. The high oxidative potential of the hole in the valence band causes the oxidation of organic compounds to form some reactive intermediates [62] as shown by Eq. (15–16).
$$ {O}_2^{\bullet -}+\mathrm{RhB}\ \mathrm{degradation}\ \mathrm{products}+{CO}_2+{H}_2O $$ (15) $$ {OH}^{\bullet }+\mathrm{RhB}\ \mathrm{degradation}\ \mathrm{products}+{CO}_2+{H}_2O $$ (16)Thus, it is necessary to prevent the recombination of electron–hole pairs to have better photocatalytic activity of semiconductor based NPs. Controlled doping of Mg over the ZnO NPs up to a certain limit can enhance the photocatalytic activities. All the Mg-doped ZnO NPs show a significant enhancement of the photo-degradation of RhB dye compared with the pure ZnO NPs. In this research, 7.5% Mg-doped ZnO NPs show better photocatalytic properties after 120 min compared with pure ZnO sample. This might be due to the change in their particle size and band gap effects [63].
Antibacterial Studies
The zone of inhibition by using Mg-doped ZnO NPs for E. coli (Gram-negative), S. aureus (Gram-positive bacteria), and Proteus (Gram-negative strains) is displayed by Fig. 10. It was carried out using disc diffusion method to observe their ability as a potential antimicrobial agent. The prepared NPs were highly reactive due to their high surface to volume ratio. From Fig. 10, it is clear that the Mg 2+ -doped ZnO NPs inhibit the growth of both Gram-negative and Gram-positive bacteria. It was observed that the zone of inhibition is proportional with the amount of Mg doping in ZnO NPs. The results obtained to show the effect of Mg doping in ZnO NPs are illustrated in Table 3. This might be attributed to the reduction in their band gap values. Due to reduction in the band gap, there is a possibility of exciton generation. Overall, this enhances the photocatalyst activities for improved bactericidal activity of Mg-doped ZnO NPs [64]. Furthermore, due to the various surface-interface characteristics may have different chemical-physical, adsorption-desorption abilities in the direction towards bacteria, make sure in different antibacterial performances [65].

Zones of Inhibition of ZnO and Mg-doped ZnO NPs against the given bacteria
The interaction between the NPs and the cell wall of bacteria was changed due to doping of Mg. The growth of S. aureus and the other two bacteria was more commendably affected by Mg 2+ -doped ZnO nanostructures compared with pure ZnO NPs. From Table 3, it is noted that Gram-negative and Gram-positive have different inhibition zones. This difference in the antibacterial activity of Mg-doped ZnO nanostructures against Gram-negative and Gram-positive bacterial strains may be due to the difference in cell wall structure of those respective bacteria. It was also reported earlier that various bacterial strains had considerably different infectivity and tolerance levels towards the different agents including antibiotics [66]. Also differences in the antibacterial activity might be due to different particle dissolution.
Basically, the antibacterial efficiency of pure and Mg-doped ZnO NPs is mainly dependent on the increased levels of reactive oxygen species (ROS), mostly hydroxyl radicals (OH) and singlet oxygen [67]. This is mainly due to the enlarged surface area which causes increase in oxygen vacancies as well as the diffusion capacity of the reactant molecules inside the NPs [68]. The reactive oxygen group contains superoxide radical and hydrogen peroxide. Both of them can damage the DNA and cellular protein leading to cell death [69]. Moreover, the presence or addition of the nanostructures on the surface or cytoplasm of the bacteria can cause the disruption of cellular function as well as disorganization of the cell membranes [70]. The doping of Mg with ZnO may lead to the variation in grain size, morphology, and solubility of Zn 2+ ionen. All these factors combined together have a robust impact on the antibacterial activity of ZnO [71, 72]. The results have revealed that Mg-doped ZnO nanostructures will be a promising candidate to be used for potential drug delivery systems to cure some significant infections in the near future.
Conclusies
To conclude, pure and Mg-doped ZnO structures were successfully synthesized by co-precipitation method. The XRD patterns revealed the wurtzite structure for all the nanosamples and no impurity phase was noted. The maximum crystallite size obtained from XRD was less than 100 nm. FE-SEM studies confirmed that the crystallite size increased with increase in Mg content. The UV-Visible results revealed that absorption underwent a redshift with Mg into ZnO as compared to pure ZnO exhibiting strong quantum confinement effects. Optical band gap energy was found to decrease from 3.36 to 3.04 eV with Mg doping, resulting in the increment in their crystallite size as a result of Mg doping. PL results confirmed the enhanced visible emissions with Mg-doped ZnO leading to the increase in delocalization of electron-hole pairs. Photocatalytic measurements revealed the increase in Mg doping in the ZnO nanoparticles that caused higher photocatalytic activity. The antibacterial activities of the synthesized nanosamples were tested against E. coli (Gram-negative), S. aureus (Gram-positive bacteria), and Proteus (Gram-negative strains).
Nanomaterialen
- Nanovezels en filamenten voor verbeterde medicijnafgifte
- Nanodeeltjes voor kankertherapie:huidige vooruitgang en uitdagingen
- Biogene synthese, karakterisering en antibacteriële potentiële evaluatie van koperoxide-nanodeeltjes tegen Escherichia coli
- Voorbereiding en verbeterde katalytische hydrogeneringsactiviteit van Sb/Palygorskite (PAL) nanodeeltjes
- Substitutionele doping voor aluminosilicaatmineraal en superieure watersplitsingsprestaties
- In vitro onderzoek naar de invloed van Au-nanodeeltjes op HT29- en SPEV-cellijnen
- Hydrothermische synthese van In2O3 nanodeeltjes hybride tweeling hexagonale schijf ZnO heterostructuren voor verbeterde fotokatalytische activiteiten en stabiliteit
- Nieuwe biocompatibele Au Nanostars@PEG-nanodeeltjes voor in vivo CT-beeldvorming en eigenschappen voor nierklaring
- synergetische effecten van Ag-nanodeeltjes/BiV1-xMoxO4 met verbeterde fotokatalytische activiteit
- Invloed van elastische stijfheid en oppervlakteadhesie op het stuiteren van nanodeeltjes
- Vergelijking tussen foliumzuur en op gH625 peptide gebaseerde functionalisering van Fe3O4 magnetische nanodeeltjes voor verbeterde celinternalisatie



