Invloed van grafeenoxide op de ethanolpermeabiliteit en ionische geleidbaarheid van op QPVA gebaseerd membraan in passieve alkalische directe ethanolbrandstofcellen
Abstract
Passieve alkaline-direct ethanol brandstofcellen (alkaline-DEFC's) lijken geschikt voor het produceren van duurzame energie voor draagbare apparaten. Ethanol-crossover is echter een grote uitdaging voor passieve alkaline-DEFC-systemen. Deze studie onderzocht de prestaties van een verknoopt gequaterniseerd poly (vinylalcohol) / grafeenoxide (QPVA / GO) composietmembraan om de ethanolpermeabiliteit te verminderen, wat leidt tot verbetering van de passieve alkalische-DEFC-prestaties. De chemische en fysische structuur, morfologie, ethanolopname en permeabiliteit, ionenuitwisselingscapaciteit, wateropname en ionische geleidbaarheid van de composietmembranen werden gekarakteriseerd en gemeten om hun toepasbaarheid in brandstofcellen te evalueren. De transporteigenschappen van het membraan werden beïnvloed door GO-belasting, met een optimale belasting van 15 gew.% en gedoteerd met 1 M KOH met de laagste ethanolpermeabiliteit (1,49 × 10 −7 cm 2 s −1 en 3.65 × 10 −7 cm 2 s −1 bij respectievelijk 30 °C en 60 °C) en de hoogste ionische geleidbaarheid (1,74 × 10 −2 S cm −1 en 6.24 × 10 −2 S cm −1 bij respectievelijk 30 °C en 60 °C). In de passieve alkaline-DEFC's was de maximale vermogensdichtheid 9,1 mW cm −2 , wat hoger is dan de commerciële Nafion 117/KOH (7,68 mW cm −2 ) bij 30 ° C met een 2 M ethanol + -2 M KOH-oplossing. Voor de 60 ° C was de maximale vermogensdichtheid van het composietmembraan dat werd bereikt 11,4 mW cm −2 .
Inleiding
Brandstofcel is een elektrochemisch apparaat dat de chemische energie van brandstof direct omzet in elektrische energie zonder enige verbranding. Deze technologie is efficiënter in het leveren van elektrische energie in vergelijking met de conventionele methode; 60% van de brandstofconversie kan worden bereikt, terwijl de conventionele methoden verschillende conversiestappen vereisen om de elektrische energie te produceren [1]. Van de verschillende typen brandstofcellen is de directe ethanol-brandstofcel (DEFC) een veelbelovende draagbare energiebron omdat deze gemakkelijk brandstof kan opslaan, een eenvoudig ontwerp heeft en minder giftige brandstof gebruikt dan andere typen brandstofcellen [2,3, 4].
Voor toepassingen met draagbare stroombronnen lijken passieve DEFC's geschikter en betrouwbaarder in vergelijking met actieve DEFC's vanwege het brandstoftoevoerconcept en de eenvoudige bediening. Het passieve voedingssysteem maakt gebruik van de natuurlijke capillaire kracht zonder tussenkomst van een pomp voor brandstof en luchtademhaling om zuurstof te leveren voor de redoxreacties. Er is dus geen extra stroomverbruik nodig. De compacte en lichte structuur van een enkele cel kan worden ontwikkeld voor een compact apparaat, dat verschilt van actieve cellen die een externe pomp en ventilator nodig hebben, waardoor de cel groter wordt [5,6,7]. Helaas belemmeren twee nadelen van passieve DEFC's hun commercieel gebruik:de trage elektrokinetische reacties van de anode en de hoge ethanolpermeabiliteit van anode tot kathode [8]. Momenteel wordt Nafion® gebruikt in DEFC's en ook gebruikt in andere soorten brandstofcellen in zuur en alkalisch milieu vanwege de hoge protongeleiding en hoge mechanische stabiliteit. Het Nafion®-membraan heeft echter verschillende nadelen die DEFC-commercialisering belemmeren, waaronder een slechte ethanolbarrière, hoge productiekosten (hoger dan de doelstelling van het Amerikaanse Department of Energy van ~ 40$/m 2 ), en het gebruik van schadelijke materialen bij de productie ervan. De hoge ethanolpermeabiliteit van DEFC's resulteert in vermogensverlies en verontreiniging van de kathodekatalysator [8,9,10].
Om de hierboven genoemde passieve DEFC-problemen aan te pakken, werden de passieve alkalische directe ethanolbrandstofcellen (alkaline-DEFC's) door onderzoekers onderzocht als alternatief systeem. De passieve alkaline-DEFC's werken onder alkalische omstandigheden om de volgende voordelen te bereiken ten opzichte van systemen met zure omstandigheden:(1) de snelheid van ethanoloxidatie in de anodekatalysator is hoger, (2) de kosten van het gebruik van niet-platinakatalysatoren, zoals Ag of Ni, lager is, en (3) de OH − stroomrichting is tegengesteld aan de ethanoldiffusiestroom in het membraan en kan dus de crossover van ethanol door het membraan aanzienlijk verminderen vanwege de verminderde invloed van ionische beweging [11,12,13]. Als het "hart van de DEFC" is het gebruik van anionenuitwisselingsmembranen de afgelopen jaren uitgebreid onderzocht [8]. Commerciële quaternaire ammonium-AEM's kunnen hydroxide-anionen geleiden; helaas is de geleidbaarheid van AEM's nog steeds slecht. Bovendien zijn de functionele groepen in conventionele AEM's nodig bij het alkalische brandstofverbruik met een hogere concentratie en worden ze afgebroken wanneer de bedrijfstemperaturen hoger zijn dan 60 °C [14,15,16,17]. Daarom is er dringend behoefte aan een alternatief membraan voor AEM's voor passieve alkaline-DEFC-toepassingen.
Poly (vinylalcohol) (PVA) is een aantrekkelijk polymeer dat het potentieel heeft om de commerciële AEM's te vervangen vanwege de uitstekende chemische weerstand, mechanische stabiliteit en het vermogen om als brandstofbarrière te dienen. Bovendien is het maken van PVA-membranen eenvoudig omdat het filmvormingsproces zeer eenvoudig is en de hydrofiele eigenschappen van de hydroxylgroepen de hoge dichtheid van reactieplaatsen voor verknopingsreacties hebben vergemakkelijkt, wat de mechanische eigenschappen en thermische stabiliteit van het membraan verbetert [18, 19,20,21]. De maximale vermogensdichtheid van een op PVA gebaseerd membraan kan oplopen tot 8,0 mW cm −2 onder omgevingsomstandigheden voor de passieve modus van alkaline-DEFC's en 82 mW cm −2 bij 80 °C voor de actieve modus van alkaline-DEFC's zoals gerapporteerd in eerdere onderzoeken [4, 13].
In alkalische media maakt PVA-gedoteerd kaliumhydroxide (KOH) PVA tot een effectieve stabiele elektrolyt, die de waterstofbruggen en dipool-dipool-interacties vormt die resulteren in een goede ionische geleidbaarheid in de stabiele structuur van AEM's [22,23,24,25 ]. Op basis van eerdere studies tolereren met KOH gedoteerde PVA-gebaseerde membranen een Fenton-oplossing (bijvoorbeeld een redox-omgeving) en vertonen ze een aanzienlijke chemische resistentie [23, 26]. Daarom heeft deze combinatie een hogere chemische stabiliteit ten opzichte van alkalische behandeling dan andere anionenuitwisselingsmembranen. Wanneer nanovulstoffen in de PVA-matrix worden geïntegreerd, kan een fysiek verknopingsmechanisme de dimensionale stabiliteit verder verbeteren en de oplossing in water en ethanol-crossover weerstaan. Bovendien is PVA een goedkoop materiaal dat de kosten van de fabricage van DEFC's verlaagt en het is niet-toxisch en biologisch afbreekbaar, waardoor het een groen materiaal is [11, 23, 27, 28].
Helaas zijn er twee belangrijke nadelen van PVA indien toegepast als AEM, waaronder een slechte ionische geleidbaarheid en een hoge zwelverhouding als gevolg van een hoge wateropname [29, 30]. Introductie van functionele quaternaire ammoniumgroepen in de PVA-matrix speelt een belangrijke rol bij het verbeteren van de ionische geleidbaarheid. Gequaterniseerd poly (vinylalcohol) (QPVA) is afgeleid van de modificatie van PVA met glycidyltrimethylammoniumchloride (GTMAC). QPVA lost het probleem van lage ionische geleidbaarheid op en verbetert de hydrofiliciteit en waterselectiviteit [31,32,33,34]. Xiong et al. [31] meldde dat de ionische geleidbaarheid van het QPVA-membraan 7,34 × 10 −3 was S cm −1 als AEM, terwijl Yang et al. [34] is erin geslaagd de ionische geleidbaarheid van een op QPVA gebaseerd membraan te verhogen tot 2,11 × 10 −2 S cm −1 bij 60 °C. Op basis van onze kennis is er echter nog geen onderzoek gedaan naar het potentieel van een op QPVA gebaseerd membraan op een passief alkalisch-DEFC-systeem.
Zoals gemeld in eerder werk, heeft een op QPVA gebaseerd membraan een hoge wateropname, wat leidt tot een hoge brandstofdoorlaatbaarheid en een afname van de mechanische sterkte. Deze toestand kan worden verbeterd door het mengproces met een anorganische vulstof of andere polymeren om een op QPVA-composiet gebaseerd membraan te vormen [35, 36]. Rajesh Kumar et al. [37] rapporteerde dat de ethanolpermeabiliteit van een op QPVA gebaseerd membraan hoog was, in het bereik van (0,95-2,08) × 10 −6 cm 2 s −1 . In deze studie wordt QPVA gecombineerd met grafeenoxide (GO) als AEM's om de prestaties van passieve alkaline-DEFC's met lage ethanolpermeabiliteit en hoge ionische geleidbaarheid te verbeteren. Momenteel is GO het meest gebruikte anorganische materiaal vanwege zijn speciale eigenschappen, waaronder het potentieel om de thermische en mechanische sterkte van polymeren te verbeteren, goed netwerkvermogen vanwege de aanwezigheid van rijke functionele. GO is een goede kandidaat als vulmiddel in polymeerelektrolyt vanwege de zuurstofhoudende functionele groepen, waaronder hydroxyl-, carboxyl- en epoxygroepen, die aanwezig zijn aan de rand van GO. Dit hydrofiele gebied is nuttig om het anion over de polymere elektrolyt te transporteren [38,39,40,41]. Karim et al. [42] meldde dat de ionische geleidbaarheid van GO bijna 10 −2 . was S cm −1 hoger dan het grootste deel van grafietoxide (10 −4 S cm −1 ). Bovendien is het hydrofobe gebied in de aromatische ring (sp 2 koolstoflaag) van de GO-nanobladstructuur is nuttig om het probleem van brandstofovergang te verminderen en de mechanische sterkte te verbeteren vanwege de sterke covalente binding [40,41,42,43,44]. Lin et al. [44] meldde dat GO-folie de brandstofdoorlaatbaarheid van Nafion®115-membranen kon verminderen tot 10 −7 cm 2 s −1 . Je et al. [45] heeft het PVA/GO-elektrolytmembraan toegepast in een alkalische directe methanolbrandstofcel om de celprestaties te verbeteren, wat resulteert in een toename van ongeveer 126% van de ionische geleidbaarheid en een vermindering van 55% van de brandstofdoorlaatbaarheid.
Blijkbaar zijn er geen studies die eerder zijn gerapporteerd bij het onderzoeken van de prestaties van verknoopte QPVA / GO-composietmembranen in passieve alkaline-DEFC-systemen. Het doel van deze studie is om een zelfgesynthetiseerd op QPVA gebaseerd membraan te maken met geschikte nanovullerladingen die de ethanol-crossover effectief verminderen, waardoor de prestaties van de passieve alkaline-DEFC worden verbeterd. Zelfgemaakte GO werd gedispergeerd in de QPVA-polymeermatrix tijdens de oplossingsgietmethode om de membraanprestaties te verbeteren. De eigenschappen van het geprepareerde verknoopte QPVA/GO-composietmembraan met verschillende GO-ladingen en gedoteerd met 1 M KOH werden geëvalueerd door verschillende tests, zoals vloeistofopname, ionenuitwisselingscapaciteit, ionische geleidbaarheid en ethanolpermeabiliteit. De optimale samenstelling van GO werd bepaald op basis van de beste prestaties met betrekking tot metingen van membraanselectiviteit. De prestatievergelijking tussen verknoopte QPVA/GO-composietmembranen en met kaliumhydroxide (KOH) gedoteerd commercieel Nafion 117-membraan (ontworpen als Nafion 117/KOH) om het alkalische elektrolytmembraan in passieve alkaline-DEFC's te verschaffen, is onderzocht en is bruikbaar als een richtlijn betreffende de toepassing van alternatieve AEM's in passieve alkaline-DEFC's.
Methodologie
Materialen
Poly (vinylalcohol) (PVA) (Mw 85.000–124.000, 99 + % gehydrolyseerd), grafietpoeder, natriumnitraat (NaNO3 ), kaliumpermanganaat (KMnO4 ) en glycidyltrimethylammoniumchloride (GTMAC) werden geleverd door Sigma Aldrich. Glutaaraldehyde (GA, 25% in gedestilleerd water) werd geleverd door Nacalai Tesque, Japan. Fosforzuur (H3 PO4 ), zwavelzuur (H2 SO4 ), zoutzuur (HCl), natriumhydroxide (NaOH) en kaliumhydroxide (KOH) werden gekocht bij J.T. Baker en waterstofperoxide (H2 O2 ) werd gekocht bij HmbG Chemical. Al deze commerciële materialen werden gebruikt zonder enige zuivering.
Synthese van gequaterniseerde PVA
Een geschikte hoeveelheid PVA werd opgelost in gedeïoniseerd water onder roeren met een magnetische roerder bij 90 ° C gedurende 2 uur. Toen de resulterende PVA-oplossing homogeen, transparant en viskeus werd, werd de temperatuur van de oplossing verlaagd tot 65 ° C. Vervolgens werden de juiste hoeveelheden GTMAC en KOH (GTMAC:KOH = 1:1 mol-verhouding) toegevoegd en werd de resulterende homogene en kleurloze oplossing gedurende 4 uur continu geroerd. Watervrije ethanol werd aan de oplossingen toegevoegd om gele precipitaten van gequaterniseerde poly (vinylalcohol) (QPVA) te verkrijgen, en vervolgens werden de precipitaten gedroogd in een vacuümoven.
Synthese van grafeenoxide
De Hummer-methode werd gebruikt om grafeenoxide (GO) [46] te synthetiseren. Twee gram grafiet werd gemengd met 2 g NaNO3 in een maatkolf (500 ml). Daarna 150 ml H2 SO4 werd aan het mengsel toegevoegd en het mengsel werd gedurende 30 minuten continu geroerd in een ijsbad (0-5 ° C). Vervolgens 12 g KMnO4 werd aan het mengsel toegevoegd en de reactietemperatuur werd gedurende 4 uur beneden 20°C gehouden. Het ijsbad werd verwijderd en de reactie werd 1 dag bij 35°C geroerd totdat de oplossing pasta-achtig en bruin leek. Vervolgens werd de oplossing verdund met 100 ml gedeïoniseerd (DI) water om een bruine oplossing te vormen. Vervolgens werd 200 ml water toegevoegd om de temperatuur te verlagen. Tot slot 10 ml H2 O2 werd gegoten om de oplossing te behandelen en er werd een gele kleur waargenomen. De centrifuge werd gebruikt om de oplossing te zuiveren met 10% HCl en er werd meerdere keren gespoeld met DI-water voor de zuiveringsstap.
Voorbereiding van het gecrosslinkte QPVA/GO-composietmembraan
Een schematisch diagram van de bereidingsstappen van het verknoopte QPVA/GO-composietpolymeermembraan wordt getoond in Fig. 1. QPVA (8 wt.%) werd volledig opgelost in DI-water door gedurende 1 uur bij 75 ° C magnetisch te roeren om een homogeen en transparante oplossing. Oplossingen met verschillende GO-inhouden (5 gew.% tot 20 gew.%) werden verschaft door de GO-oplossing (1 g/L) te verdunnen. De oplossing van QPVA werd continu geroerd terwijl de GO-oplossing (2:1 volumeverhouding) gedurende 1 uur werd toegevoegd om een geelbruine QPVA/GO-oplossing te produceren. De geelbruine oplossing werd gedurende 30 minuten continu geroerd met 10 gew.% GA. De oplossing werd op een plastic plaat gegoten en het volume van de oplossing geregeld om de dikte van het membraan (0,015 mm) te fixeren. Daarna 24 uur gedroogd onder omgevingscondities en 12 uur in een vacuümoven bij 60 °C. Het membraan werd van de plastic plaat afgepeld en gedurende 1 uur op een glasplaat geplaatst voor het gloeiproces bij 100 ° C. Vervolgens werden de membranen 24 uur ondergedompeld in 1 M KOH-oplossing bij 80 ° C. De overtollige KOH op het oppervlak van het membraan werd verwijderd door herhaaldelijk te spoelen met DI-water en het membraan werd vóór gebruik bij kamertemperatuur in DI-water bewaard.
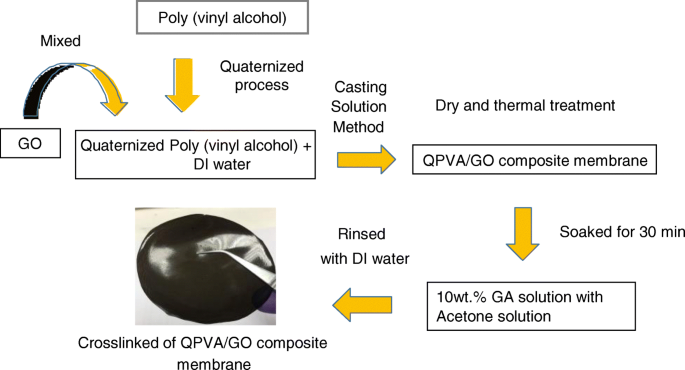
Schematisch diagram van de voorbereiding van QPVA/GO-composietmembraan
Structurele en morfologische karakterisering van het composietmembraan
Fourier-transformatie infraroodspectroscopie-analyse
Infraroodabsorptiespectra van ongerept PVA-membraan, ongerept QPVA-membraan en verknoopt QPVA / GO 15 gew.% composietmembraan werden opgenomen op een Perkin Elmer Fourier-transform infraroodspectroscopie (FTIR) met een ATR-module (verzwakte totale reflectie). De monsters werden in een monsterhouder gehouden en in het ATR-FTIR-systeem geplaatst. De FTIR-onderzoeken zijn uitgevoerd bij omgevingstemperatuur en het spectrale bereik was 400–4000 cm −1 .
Röntgendiffractie
Röntgendiffractie (XRD, model D8 Advance, Bruker AXS Duitsland) metingen werden verkregen van de verknoopte QPVA/GO-composietmembranen om hun kristalliniteit te onderzoeken. De röntgenstraling werd gegenereerd met behulp van Cu Kα-straling (golflengte van 0,15406 nm) van een anode met een bedrijfsvermogen van 40 kV en 40 mA. De scansnelheid was 0,5°s −1 , en de resolutie was 0,02°. De XRD-spectra werden opgenomen vanuit hoeken van 10° tot 50°.
Veldemissie scanning elektronenmicroscoop-energie-dispersieve röntgenspectroscopie, transmissie-elektronenmicroscopie en atoomkrachtmicroscopie
De oppervlakte- en dwarsdoorsnedemorfologieën van het verknoopte QPVA/GO-composietpolymeermembraan werden bekeken met een ZEISS SUPRA 55 VP veldemissie scanning-elektronenmicroscoop (FESEM) bij 10 kV. Energie-dispersieve röntgenspectroscopie (EDX) werd gebruikt voor het in kaart brengen van elementen. Het droge membraan werd handmatig gebroken na afkoeling in vloeibare stikstof. Transmissie-elektronenmicroscopie (TEM-Hitachi HT 7700, Japan) en atoomkrachtmicroscopie (AFM) werden uitgevoerd om de aanwezigheid en grootte van geëxfolieerde GO aan te tonen.
Thermogravimetrische analyse
De thermische eigenschappen van composietmembraan werden bepaald door middel van thermogravimetrische analyse (TGA). PVA-membraan, QPVA-membraan en QPVA/GO-composietmembraanmonsters werden verwarmd van omgevingstemperatuur tot 600 °C onder een stikstofatmosfeer in stappen van 10 °C min −1 met behulp van een thermogravimetrische analysator (TGA Q500 V20.13 Build 39).
Membraanopname, zwellingsverhouding, ionenuitwisselingscapaciteit en oxidatieve stabiliteit
De opname van alkalisch, water en ethanol van het membraan werd bepaald uit het verliesgewicht van het verknoopte QPVA/GO-composietmembraan voor en na hydratatie. De alkalische opnameprocedure werd uitgevoerd door het membraanmonster 24 uur bij 30 ° C in 2 M KOH onder te dompelen. Vervolgens werden de monsters verwijderd uit KOH, werd de oppervlaktevochtigheid van de monsters verwijderd met tissuepapier en werden de monsters onmiddellijk gewogen op een microbalansmassa om het bevochtigde membraangewicht te verkrijgen (W nat ). Vervolgens werden de monsters 2 uur in een oven bij 100 °C gedroogd om het gedroogde membraangewicht te bepalen (W droog ). De alkalische opname (W ) werd berekend met behulp van de volgende vergelijking. (1):
$$ W=\frac{W\ \mathrm{wet}-W\ \mathrm{dry}}{W\ \mathrm{dry}}\times 100 $$ (1)Voor de opname van water en ethanol werd de procedure aangepast door de oplossingsbehandeling te vervangen door water en 2 M ethanol.
De zwelverhouding van het verknoopte QPVA/GO-composietpolymeermembraan werd onderzocht door de 100 mm 2 monsters in DI-water bij 25 ° C gedurende 24 uur. Vervolgens werd het monster uit DI-water gehaald, de vochtigheid van het oppervlak verwijderd met tissuepapier en de dikte van het membraan werd gemeten om de bevochtigde membraandikte te verkrijgen (t nat ) met behulp van een micrometer (Mitutoyo, ± 1 m). Vervolgens werden de monsters 2 uur in een oven bij 100 °C gedroogd om de gedroogde dikte te bepalen (t droog ). De zwelverhouding (Sr DI water ) werd berekend met behulp van de volgende vergelijking. (2):
$$ Sr=\frac{t\ \mathrm{wet}-t\ \mathrm{dry}}{t\ \mathrm{dry}}\times 100 $$ (2)De klassieke titratiemethode werd gebruikt om de ionenuitwisselingscapaciteit (IEC) van de composietmembranen te meten. De composietmembranen werden gedrenkt in een 0,1 M NaOH-oplossing om ze om te zetten in OH − . Vervolgens werden de composietmembranen gewassen met DI-water om overmaat NaOH te verwijderen en 48 uur geëquilibreerd met 100 ml 0,1 M HCl-oplossing. Vervolgens werden de IEC-waarden bepaald uit de zuurreductie gemeten met terugtitratie. De formule die wordt gebruikt om de IEC-waarden te berekenen (meq g −1 ) wordt hieronder gegeven:
$$ \mathrm{IEC}\kern0.37em \left(\mathrm{meq}.{\mathrm{g}}^{\hbox{-} 1}\right)\kern0.5em =\kern0.75em \frac {M_{\mathrm{b}}-{M}_{\mathrm{a}}}{m\ } $$ (3)waar M b vertegenwoordigt de milli-equivalenten (meq) van HCl vereist voor evenwicht, M een staat voor de HCl die nodig is na evenwicht, en m is de massa (g) van het gedroogde composietmembraan.
De oxidatieve stabiliteitstest werd gemeten via Fenton's reagens (3% H2 O2 waterige oplossing met 2 ppm FeSO4 ). De monsters (40 mm × 40 mm) werden ondergedompeld in het Fenton's reagens bij 25 ° C. Het gewicht van het membraan voor en na onderdompeling werd na 24 uur geregistreerd. Elke verandering van het membraan als het monster begon te breken of te smelten in de oplossing was de aankondiging van de maximale testtijd.
Ionische geleidbaarheid, ethanolpermeabiliteit en selectiviteitsfactor
De ionische geleidbaarheid werd bepaald met behulp van een geleidbaarheidscel met vier elektroden die was aangesloten op een potentiostaat/galvanostaat van een impedantieanalysator (WonATech-WMPG1000), die werd gebruikt om de weerstand van de membraancomposieten te verkrijgen uit de helling van de E–I-curve [47]. Alle metingen werden uitgevoerd met behulp van Eq. (4):
$$ \sigma =\frac{L}{RS} $$ (4)waar σ, L , R , en S vertegenwoordigen de protongeleidbaarheid (σ, S cm −1 ), de afstand tussen de tegenelektroden (L, cm), de weerstand van de membranen (R, S −1 ), en het dwarsdoorsnede-oppervlak van de membraanmonsters (S, cm 2 ), respectievelijk. De verknoopte PVA/GO-composietmembranen werden geëquilibreerd in gedeïoniseerd water bij verschillende temperaturen (30-60 ° C). De membranen werden in de dwarsrichting geplaatst en tussen de elektroden ingeklemd.
Een diffusiecel met twee glazen compartimenten werd gebouwd om de membraan-ethanolpermeabiliteit te bepalen. De glazen van de twee compartimenten werden verdeeld om het voedingscompartiment te vormen, dat gevuld was met 2 M, 4 M, 6 M of 8 M ethanol, en een tweede kamer die gevuld was met gedeïoniseerd water. Elk compartiment bevatte een magnetische roerstaaf voor het roeren van de oplossing. Het membraan werd verticaal tussen de twee glazen compartimenten geklemd [47]. Tijdens het experiment werd de concentratie ethanol gemeten die het membraan passeerde. De membraanpermeabiliteit werd berekend met behulp van de volgende Vgl. (5):
$$ P=\frac{1}{Ca}\left(\frac{\Delta Cb(t)}{\Delta t}\right)\left(\frac{LVb}{A}\right) $$ ( 5)waar P vertegenwoordigt de ethanoldiffusiepermeabiliteit van het membraan (cm 2 s −1 ), Ca staat voor de concentratie van de voedingskamer in cel A (mol L −1 ), ∆Cb (t )/het geeft de helling weer van de molaire variaties van de ethanolconcentratie in cel B als functie van de tijd (mol L −1 s), Vb staat voor het volume in elk van de diffusiereservoirs (cm 3 ), A vertegenwoordigen het membraan, en L vertegenwoordigen de dikte van het membraan (cm). Alle concentratie-oplossing werd gemeten met een refractometer. De selectiviteitsfactor van de verknoopte QPVA/GO-composietpolymeermembranen (de verhouding van de ionische geleidbaarheid tot de ethanolpermeabiliteit) werd bepaald met behulp van de volgende vergelijkingen. (6) en (7):
Selectiviteit,
$$ \Phi =\frac{P}{\sigma } $$ (6)Enkele cel van passieve alkalische-DEFC prestatie- en duurzaamheidstest
Figuur 2 toont de enkele cel van passieve alkaline-DEFC zelfgemaakte en de membraan-elektrode-assemblage (MEA). De MEA voor de passieve alkaline-DEFC-testcel werd geconstrueerd en het composietmembraan werd via een heetpersmachine tussen beide elektroden (de anode en kathode) geklemd. Voor de anode werd een Pt–Ru-katalysator toegepast van 4 mg cm −2 , en voor de kathode werd een Pt-katalysator toegepast van 4 mg cm −2 via een handmatige giettechniek tot een gasdiffusielaag van carbonpapier. Pt-Ru en Pt werden geleverd door Alfa Aesar, VS. De DEFC-prestaties zijn getest door passieve luchtademhaling met een zelfgemaakte eencellige stapel met een actief MEA-oppervlak van 4 cm 2 . Het brandstofreservoirgebied van de stapel met één cel zorgt voor 2 ml brandstof. De polarisatiegegevens werden verkregen met behulp van de potentiostaat/galvanostaat (WonATech) om de spanningsrespons te meten door de belastingsstroom toe te passen op een enkele cel onder omgevingsomstandigheden. Vervolgens werd 2 M KOH + 2 M ethanol als brandstof in het anodische reservoir omgezet en diffundeerde de omringende lucht in de kathodeopening tijdens de prestatietests. De enkele cel van passieve alkaline-DEFC werd onderzocht op een duurzaamheidstest gedurende een periode van 1000 uur bij 60 ° C. Vanwege passieve brandstoftoevoer moet de ethanoloplossing elke 12 uur worden bijgevuld. De duurzaamheidsprestatietests werden uitgevoerd in continue werking, constante belasting waarbij de celspanning constant was op 0,3 V. Nadat de duurzaamheidstest was voltooid, werd de polarisatietest van een enkele cel herhaald om de prestaties te vergelijken.

De enkele cel van passieve alkaline-DEFC en MEA
Resultaten en discussie
Karakterisatie en morfologie van de composietmembranen
De quaterniseringsgraad is 2,6% en de resterende 97,4% is matrixpolymeer van PVA [23]. Er werden zes verschillende soorten membranen geproduceerd; ongerept PVA-membraan, verknoopt QPVA-membraan en vier verknoopte QPVA/GO-composietmembranen met verschillende gewichtspercentages, respectievelijk 5 gew.%, 10 gew.%, 15 gew.% en 20 gew.%. Tabel 1 geeft het resultaat weer van de elementaire mapping van het ongerepte PVA-membraan en het verknoopte QPVA/GO 15 gew.% composietmembraan door EDX-spectroscopie. Het PVA-composietmembraan bevatte koolstof (C) en zuurstof (O). Ondertussen bevatten de verknoopte QPVA/GO 15 wt.% composietmembranen koolstof (C), stikstof (N) en zuurstof (O), wat aangeeft dat de quaternaire ammoniumgroep met succes in de PVA-matrix was geënt. De introductie van GO in QPVA veroorzaakte een toename van het gewicht en het atoompercentage van O in het composietmembraan vanwege de zuurstofhoudende functionele groepen van GO (hydroxyl-, carboxyl- en epoxygroepen). Het bewijs dat de betrokkenheid van QPVA en GO ondersteunt, werd verder onderzocht met behulp van vibratiespectroscopie uit FTIR-analyse. De functionele groepen van PVA, QPVA en QPVA/GO 15 gew.% composietmembranen werden geregistreerd in het gebied van 400-4000 cm −1 , zoals weergegeven in Afb. 3.
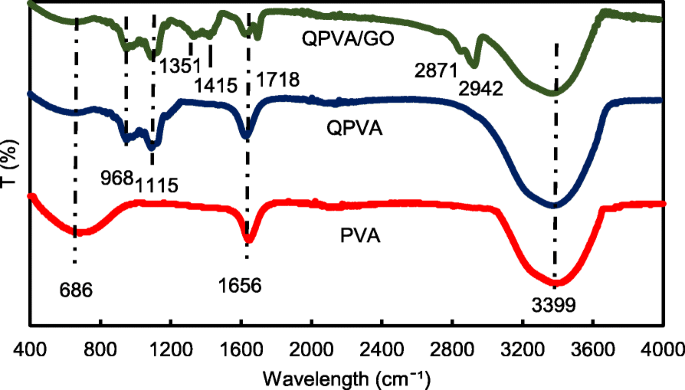
FTIR-spectra met golflengte 400–4000 cm −1
Afbeelding 3 toont het golflengtebereik van 400 tot 4000 cm −1 . De absorptiepiek bij 686 cm −1 in het PVA-membraan komt overeen met de alifatische C–H-buiging [3]. Na het quaterniserings- en verknoopte proces was de alifatische C-H-buiging verminderd en verschenen er verschillende nieuwe pieken in het spectrum van het verknoopte QPVA-membraan en het verknoopte QPVA/GO 15 gew.% composietmembraan. De piek bij 968 cm −1 werd gekarakteriseerd als alifatisch C-N, wat aangeeft dat de quaternaire ammoniumgroep was geënt op de ruggengraat van het matrixpolymeer [31]; en de piek op 1115 cm −1 geeft de C–O–C-rekgroep aan die verscheen na de verknopingsbehandeling en bewijst dat de verknopingsreactie plaatsvond en dat het composietmembraan met succes werd verknoopt door GA [12]. Er zijn verschillende nieuwe pieken die verschijnen in het composietmembraan in vergelijking met ongerept PVA en verknoopt QPVA; de piek op 1351 cm −1 staat voor epoxy C-O symmetrische trillingen van GO [23]; de piek op 1415 cm −1 vertegenwoordigt de strektrillingen van carboxylgroepen (O=C-O) uit GO [44]; de vervorming van de piek op 1656 cm −1 toegeschreven aan de geïntegreerde C=C die zich uitstrekt van de aromatische structuur die overeenkomt met de sp 2 karakter van het GO hydrofobe gebied en reactie van de ruggengraat van matrixpolymeer [39]; de nieuwe piek op 1718 cm −1 het gevolg was van -COOH-uitrekking in de carboxylgroep in de GO [23]; de nieuwe pieken verschijnen in het composietmembraan op 2871 cm −1 , die horen bij =C–H stretching en op 2942 cm −1 , de toename van de asymmetrische en symmetrische rek van –CH2 van de GO kan worden waargenomen. Na de wijziging van PVA, een sterke en brede absorptie bij 3399 cm −1 kan worden waargenomen als gevolg van de verzwakking van -OH-uitrekking die wordt beïnvloed door de vorming van waterstofbindingen met de functionele groep van GO. Uit de FTIR-spectraalanalyse toonden de pieken van het quaternisatieproces van PVA en de synthese van GO duidelijk functionele groepen en hydrofobe regio's vergelijkbaar met eerdere studies [23, 31, 44], wat erop wijst dat het verknoopte QPVA/GO-composietmembraan met succes was gesynthetiseerd.
Röntgendiffractiemeting werd uitgevoerd om de kristalliniteit van het composietmembraan te observeren. De illustraties van het diffractiepatroon voor de XRD-analysepiek worden weergegeven in Fig. 4a, b. Lee et al. [43] heeft gemeld dat de piek van grafiet 25,6° bedraagt. Figuur 4a toont de XRD-spectra van zelfgemaakte GO met de progressieve faseverandering van grafiet naar GO. De piekintensiteit is iets hoger bij 10,92 ° als gevolg van geëxfolieerd van GO na oxidatieproces. De veranderingen treden op als gevolg van de interactie tussen het hydrofobe gebied met de gedispergeerde zuurstofische functionele groep aan de rand van de GO-benzeenstructuur [43]. De grote piekaanwezigheid in het XRD-patroon bij 19-20 ° en de kleine piek bij 39-40 ° waren indicatoren van de semi-kristallijne structuur van PVA zoals weergegeven in figuur 4a. De piekintensiteit van QPVA bij 19-20 ° was verlaagd in vergelijking met de pure PVA vanwege de introductie van een functionele ammoniumgroep die de semi-kristallijne structuur van PVA verstoorde. Daarom wordt het amorfe gebied domein in de QPVA-polymeermatrix. Deze structuur heeft bijgedragen aan de verbetering van de ionische geleidbaarheid door de toename van vrije volumes in de polymeerketen die zorgen voor meer vrije ruimte die fungeert als het ionische pad door het membraan met de lokale structurele relaxatie en segmentale bewegingen van het polymeer [26]. Figuur 4b laat zien dat de grote diffractiepiek van GO onzichtbaar was, wat aangaf dat GO door fysieke interactie homogeen was verspreid in de QPVA-matrix. Met name de GO-piek bij 2θ =-10,92 ° was bijna onzichtbaar vanwege de volledige afschilfering en vernietiging van het originele vel door opname in het QPVA-polymeer. Dit resultaat bevestigde dat de synthese van een verknoopt QPVA/GO-composietmembraan de vorming van waterstofbruggen en de interacties op het ionische niveau tussen de polymeerketens en de functionele groepen in GO omvatte [23, 39]. De diffractie-intensiteit van de QPVA bij 19-20 ° werd nog steeds gedetecteerd, wat impliceert dat de mate van QPVA-kristalliniteit werd gehandhaafd tot de toevoeging van grafeenoxide bij een belading van 20 gew.%. Daarom veranderde de chemische structuur van de QPVA-composietfilms nauwelijks naarmate de grafeenoxidelading toenam, wat aangeeft dat er veel fysieke interacties waren, maar weinig chemische reacties die plaatsvonden tussen de QPVA en grafeenoxide in het composietmembraanvormingsproces [39, 48]. Bovendien heeft de amorfe structuur van het composietmembraan een significant effect op de ionische geleidbaarheid vanwege de vorming van vrij volume door constant fragmentarische beweging van de polymeermatrix. Dus de aanwezigheid van GA als een verknoopt en KOH als een gedoteerd middel in de polymeermatrix zorgde voor meer route voor ionen om door het membraan te gaan [27, 49,50,51].
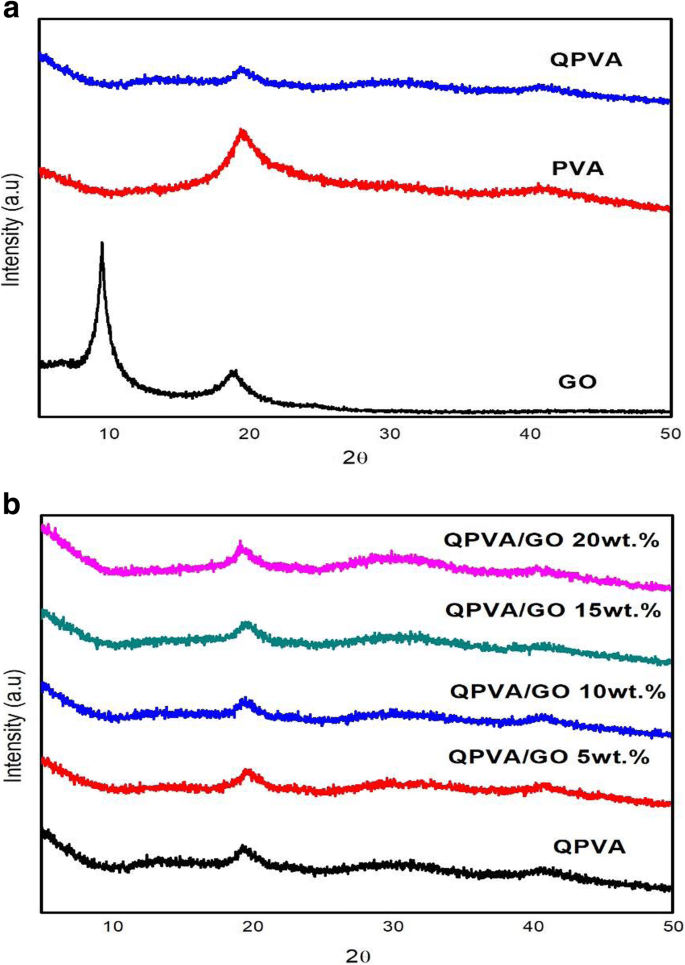
XRD-patronen van a GO, PVA en QPVA; b QPVA, QPVA/GO composietmembraan
De FESEM-, TEM- en AFM-afbeeldingen werden gebruikt om de morfologische kenmerken van GO te identificeren, zoals weergegeven in Fig. 5. Figuur 5a, b toont de FESEM- en TEM-afbeeldingen, wat duidelijk lijkt op de enkele laag grafeenoxide (zoals een vel papier) werd met succes geëxfolieerd van de grafietvlokken. AFM werd gebruikt om de GO-laagdikte van 0,87 nm te meten, zoals weergegeven in figuur 5c. De verkregen GO-dikte bevestigt dat de geëxfolieerde enkele laag van GO met succes is gesynthetiseerd. De morfologieën van het voorbereide membraan worden getoond in Fig. 6a-d door FESEM bij een vergroting van × 10,00 k. Alle bovenaanzichten van FESEM-afbeeldingen laten zien dat alle membranen dicht zijn en ongescheurd blijven, hoewel er annealing is bij 100 ° C, wat de uitstekende chemische stabiliteit bewijst door de verknoping en modificatie met GO in de QPVA-matrix. Deze eigenschap is belangrijk voor gebruik als polymeer-elektrolytmembraan in DEFC-toepassingen, vooral om de brandstofovergang te voorkomen. Het oppervlak van het PVA-membraan lijkt erg glad, zoals weergegeven in figuur 6a, terwijl het QPVA-membraan in figuur 6b een andere morfologie vertoont, aangezien de korrelverdeling duidelijk verscheen, wat aangeeft dat het PVA met succes werd geënt met quaternaire ammoniumgroepen [27] . Afbeelding 6c toont het bovenaanzicht van het QPVA/GO-composietmembraan, wat de willekeurige verdeling van GO in de QPVA aangeeft, wat aantoont dat GO met succes is geëxfolieerd en door het membraan is verspreid. Uit de dwarsdoorsnede in Fig. 6d vertoont het composietmembraan een dichte en compacte structuur met een hoge homogeniteit, wat wijst op de unificatie van QPVA en GO in het composietmembraan zonder gaten. Bovendien vulde de aanwezigheid van GA en KOH het vrije volume in de polymeermatrix. Dit zijn de belangrijke kenmerken voor scheiding en vermindering van brandstofcrossover. Vandaar dat de homogene afschilfering van GO, dispersie van GA en KOH de ionische geleidbaarheid verbetert en de ethanolpermeabiliteit vermindert [23, 24, 52, 53].

FESEM-, TEM- en AFM-beeld van geëxfolieerd grafeenoxide

FESEM-afbeelding van a oppervlakte PVA-membraan, b oppervlak QPVA-membraan, c oppervlak van QPVA/GO composietmembraan, en d dwarsdoorsnede van QPVA/GO composietmembraan
Thermische stabiliteit
De thermische stabiliteit van het verknoopte QPVA/GO-composietmembraan werd geïllustreerd door TGA-onderzoeken. Figuur 7 toont de TGA-curves voor het zuivere PVA-membraan, QPVA-membraan en QPVA/GO 15 gew.% composietmembraan. De TGA-curven van deze drie membranen geven drie belangrijke gebieden voor gewichtsverlies weer. Het eerste gebied is bij 70-130 ° C als gevolg van het verlies van geadsorbeerd water in het membraan door de verdamping van respectievelijk de zwakke en sterke fysische en chemische bindingen van water. Het gewichtsverlies van alle membranen is ongeveer 5-8 gew.%. Het tweede overgangsgebied van gewichtsverlies bij ongeveer 230-320 ° C wordt toegeschreven aan de ontleding van de zijketens van de matrixpolymeren. Het gewichtsverlies van het membraan was 75 gew.% voor PVA, 70 gew.% voor QPVA en 60 gew.% voor QPVA/GO; het totale gewichtsverlies van PVA was het hoogst vanwege de aanwezigheid van minder zijketengroepen in vergelijking met QPVA/GO. Het derde overgangsgebied van gewichtsverlies bij ongeveer 430-480 ° C werd toegeschreven aan de ontleding van de hoofdketen van het membraan als gevolg van splitsing van de C-C-ruggengraat van de matrixpolymeren. Bij 600 °C was de resterende massa van het PVA-membraan 4,7 gew.%. De restmassa van het QPVA-membraan en het QPVA/GO-membraan waren respectievelijk 7,67 gew.% en 22,2 gew.%.
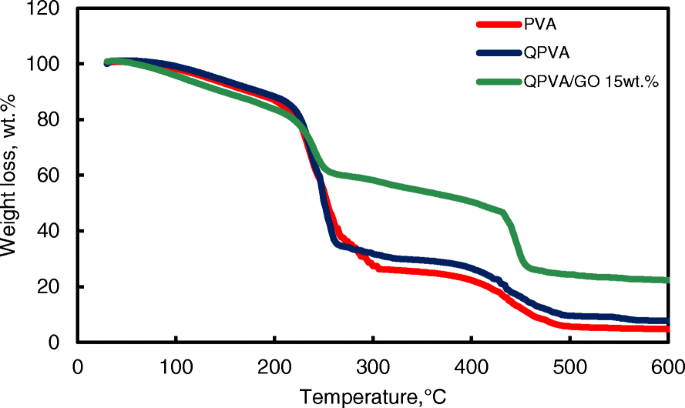
TGA-analyse van PVA-membraan, QPVA-membraan en QPVA/GO-composietmembraan
Figuur 7 laat zien dat het gewichtsverlies van het QPVA/GO 15 gew.% membraan minder was dan bij de andere membranen; dit resultaat geeft aan dat het quaternisatieproces van de PVA-matrix en de opname van GO in de composietmembranen succesvol was. De anorganische vulstof verbeterde de thermische stabiliteit van het composietmembraan en produceerde een sterk netwerk tussen het matrixpolymeer en de GO-vulstofversterking. Bovendien helpt de chemische verknopingsreactie door glutaaraldehyde bij het verbeteren van de thermische stabiliteit.
Alkalische opname, zwellingsverhouding en oxidatieve stabiliteit
Alkalische opname is het belangrijkste proces voor de bereiding van elektrolyten. De KOH die voor alkalische dotering wordt gebruikt, dient als ladingsdrager en crosslinker. De alkaline-DEFC werkte met alkalische anodebrandstof (alcohol in KOH-oplossing). Alkalische opname in het membraan is belangrijk voor het leveren van OH − ionen. De optimale KOH-opnameconditie is nodig om een hoge ionische geleidbaarheid te verschaffen. Desalniettemin leidt overmatige KOH-opname tot de vervorming van het matrixpolymeer en verslechtert de mechanische stabiliteit van alkaline-DEFC door de levensduur ervan te verkorten. De droge membraanfilms werden ondergedompeld in 2 M KOH bij 30 ° C, en de dimensionele stabiliteit werd geschat met behulp van de veranderingen van het membraangewicht voor alkalische opname en de breedte, lengte en dikte voor de zwelverhouding van de membraanfilms voor en na doping met 2 M KOH. Tabel 2 laat zien dat de alkalische opname van het PVA-membraan 105% was. Na het quaternisatieproces leidden de hydrofiele structuur C–H en de aanwezigheid van quaternaire ammoniumgroepen tot een alkalische opname van QPVA-membraan tot 136%. De introductie van GO in QPVA bracht echter de vermindering van de alkalische opname tot 45% in verband met 20 gew.% belading van GO. Het hydrofobe gebied van GO draagt bij aan een "blokkerend effect" in de polymeermatrix en vermindert zo de KOH-absorptie van de membranen. Bovendien zou het verknopingsmiddel ook de alkalische opname kunnen verminderen vanwege de compactere netwerkstructuren die in de composietmembranen zijn gevormd [23, 50]. De alkalische opname heeft invloed op het zwelgedrag van de composietmembranen.
De verhoudingen van zwelling in het vlak (dwz breedte en lengte) en zwelling in het vlak (dwz dikte) van de composietmembranen worden weergegeven in Tabel 2. Over het algemeen is een lage zwellingsverhouding van het membraan gunstig voor het tolereren van de dimensionale overeenkomst tussen de elektrode en membraan; dus wordt de stabiele vorming van MEA aangemoedigd tijdens prestaties van een enkele cel. De zwelverhoudingen in het vlak en door het vlak voor het QPVA-membraan waren respectievelijk 18% en 60%. De introductie van GO tot 20 gew.% belasting in QPVA verminderde de zwellingsverhoudingen in het vlak en door het vlak tot respectievelijk 7,54% en 32%. De introductie van GO bevordert niet alleen de vorming van verbonden ionische transportkanalen, maar vergroot ook het hydrofobe gebied van GO in de matrix QPVA, wat resulteert in de dimensionele stabiliteit van de composietmembranen [23, 52]. Het verknoopte QPVA/GO 20 gew.% composietmembraan vertoonde lagere zwelverhoudingen dan het ongerepte QPVA-membraan. Liao et al. [26] rapporteerde een lage zwelverhouding in het vlak vanwege de sterke interacties tussen de polymeermatrix en het vulmiddel, waaronder dipool-dipool-interacties, waterstofbinding en van der Waals-interacties tussen het polymeer en GO. Alle monsters vertonen goede zwelverhoudingen in het vlak in plaats van zwelverhoudingen door het vlak, wat gunstig is voor de MEA-contactomstandigheden.
De oxidatieve stabiliteit van het anionenuitwisselingsmembraan werd gemeten in de Fenton's reagenstest die bekend staat als de versnelde oxidatieve stabiliteitstest. Tabel 1 toont het behouden gewichtspercentage van de verknoopte QPVA/GO-membranen. Na 24 uur onderdompeling is het behouden gewicht van het QPVA-membraan 97%. Het nam iets af met toenemende GO-lading, waardoor het gewicht van 91% bleef voor 20 gew.% GO. De verkregen resultaten toonden aan dat de vrije radicalen weinig invloed hebben op de op QPVA gebaseerde membranen vanwege de grotere oxidatieve weerstand van de waterstofbinding gevormd tussen GO, GA en polymeermatrix. Dit kan te wijten zijn aan de aanwezigheid van zuurstofhoudende functionele groepen die aanwezig zijn in de GO die gemakkelijk waterstofbindingen vormen met ongerepte QPVA [1, 23, 54]. De resultaten van het gewichtsverliespercentage geven aan dat het verknoopte QPVA/GO-membraan een goede oxidatieve stabiliteit heeft tegen Fenton's reagens.
Wateropname, ionenuitwisselingscapaciteit en ionengeleiding
Wateropname is een belangrijke parameter voor ionenoverdracht in het elektrolytmembraan. Maar een hogere wateropname zal de membraanprestaties verslechteren [8, 50]. Uit figuur 8 blijkt dat de modificatie van op QPVA gebaseerd membraan en GO met succes de wateropname van 145 tot 46% heeft verminderd. Ionenuitwisselingscapaciteit (IEC) is een belangrijke parameter voor het evalueren van het mobiliteitsvermogen van anionen door het membraan. Bovendien is IEC nuttig om het bereik van optimale wateropname te bepalen die de geleidbaarheid van het membraan door het voertuigmechanisme verbetert [33, 55]. Afbeelding 8 laat zien dat de waarden van de experimentele IEC varieerden van 1,05 tot 2,71 meq g −1 volgens de toename van de GO-belasting. Het bestaan van quaternaire ammoniumgroeptransplantaten op matrixpolymeer en toenemende hoeveelheden GO heeft geleid tot de toevoeging van zuurstofhoudende functionele groepen, waaronder hydroxyl-, carboxyl- en epoxygroepen, die nuttig zijn voor anionoverdracht via de Hopping @ Grotthus-mechanismen [22, 35 ]. Hogere IEC-waarden zijn de belangrijkste indicator van een hogere ionische geleidbaarheid vanwege de hoge ladingsdichtheid in het membraan [33, 55].
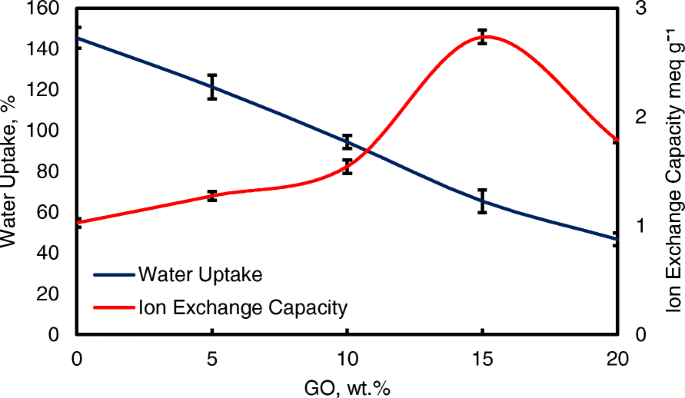
Wateropname en IEC-analyse van QPVA-membraan en QPVA/GO-composietmembraan bij 30 °C
Figuur 9 toont ook de ionische geleidbaarheid van het QPVA-membraan en het verknoopte QPVA/GO-composietmembraan bij 30 °C. De ionische geleidbaarheid van het QPVA-membraan (4.7 × 10 −3 S cm −1 ) is hoger in vergelijking met het PVA-membraan (1,05 × 10 −3 S cm −1 ). De geënte quaternaire ammoniumgroep op de PVA-ruggengraat helpt bij het verhogen van de ionische geleidbaarheid door de OH − dat effectief is overgedragen via de route die is gecreëerd door de aanwezigheid van functionele groepen in GO [31]. De ionische geleidbaarheid van composietmembranen werd verhoogd, wat werd geregistreerd als 7,3 × 10 −3 S cm −1 , 11,3 × 10 −3 S cm −1 , en 17.56 × 10 −3 S cm −1 voor GO-lading bij respectievelijk 5 gew.%, 10 gew.% en 15 gew.%. De introductie van GO in het composietmembraan tot 10 gew.% toonde een lichte toename in ionische geleidbaarheid toegeschreven aan het "blokkerende effect" van de GO sp 2 karakteristiek reagerend als een hydrofoob gebied voor ionische clusters in het composietmembraan.
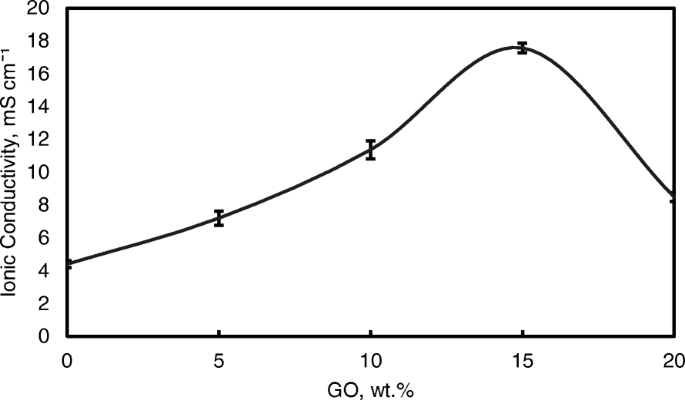
Ionische geleidbaarheidsanalyse van QPVA-membraan en QPVA/GO-composietmembraan bij 30 °C
Boven 10 gew.% van de GO-lading (15 gew.%), nam de ionische geleidbaarheid van het composietmembraan echter toe tot 17,35 × 10 −3 S cm −1 vanwege de voldoende sterk geoxygeneerde functionele groepen (hydroxyl, carboxyl en epoxy) in GO om alternatieve anionroutes te bieden en het blokkerende effect van het hydrofobe gebied te overweldigen. De toevoeging van GO heeft dus de ionische geleidbaarheid van de composietmembranen verbeterd [43]. De zuurstofhoudende functionele groepen van GO, zoals carboxylgroepen, kunnen complexen vormen met KOH-moleculen en vormen goede ionengeleiders met snelle kanalen voor anionuitwisseling en transport. Deze voorwaarde is nuttig voor het springmechanisme [23, 52]. Bovendien vormen de sterke interacties tussen GO, de polymeermatrix en GA een driedimensionaal netwerk dat water en alkalische moleculen kan bevatten die belangrijk zijn in het voertuigmechanisme. Ionisch transport is afhankelijk van de alkalische moleculen en de wateropname vindt plaats door het voertuigmechanisme. In de composietmembranen konden de alkalische moleculen worden geclassificeerd als vrij alkalisch en gebonden alkalisch. Voor geleidbaarheid beïnvloedt alleen de vrije alkali het aniontransport [23, 56]. Afbeelding 10a geeft de illustratie van ionentransport weer voor verknoopt QPVA/GO-composietmembraan.
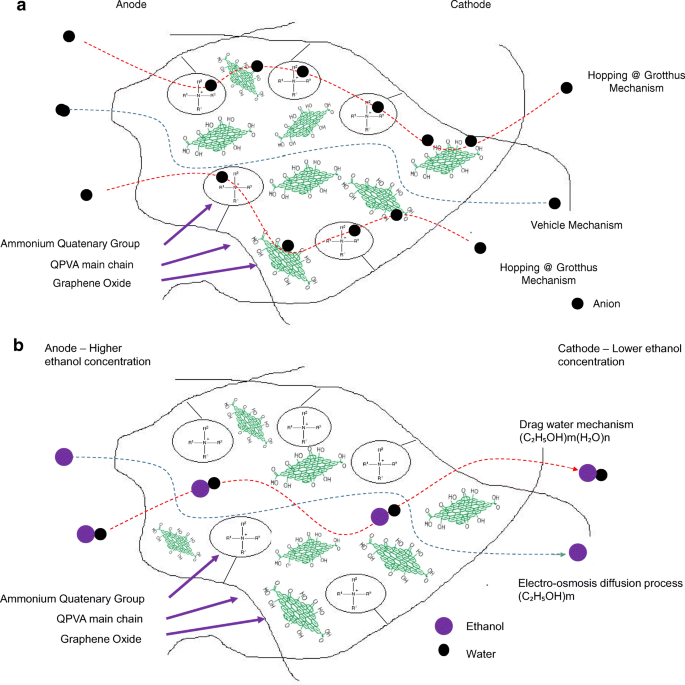
een Illustratie van ionische overdracht voor het verknoopte QPVA/GO-composietmembraan. b Illustratie van ethanoloverdracht voor het verknoopte QPVA/GO-composietmembraan
Toen de GO-belasting echter 20 gew.% overschreed, nam de ionische geleidbaarheid van het composietmembraan af als gevolg van de afname van de alkalische opname door het composietmembraan, wat werd toegeschreven aan het GO-hydrofobe gebied. Daarom verstoort deze toestand het Grotthuss-mechanisme bij het transporteren van de ionische diffusie, waardoor de ionische geleidbaarheid van het composietmembraan wordt verminderd. Hogere temperatuur verhoogt de ionische geleidbaarheid vanwege het effect van snelle anionmobiliteit. Bovendien wordt de afstand tussen de polymeerketens groter bij hogere temperatuur, wat meer vrij volume oplevert en de beweging van watermoleculen vergemakkelijkt om de geleidbaarheid van anionen te verbeteren [1, 45]. Afbeelding 11 toont de trend van de ionische geleidbaarheid wanneer de temperatuur toenam. Toenemende temperatuur leidde ook tot toenemende ionische geleidbaarheid. De hoogste ionische geleidbaarheid was 4,6 × 10 −2 S cm −1 bij 60 ° C voor 15 gew.% GO-lading. Vergeleken met het vorige onderzoek naar op PVA gebaseerde membranen in DEFC's, zoals PVA/HPW/DPTA, PVA/TMAPS, PVA/LDH en PVA/CNT's [11,12,13, 50], toonde het huidige QPVA/GO-membraan de hoogste ionische geleidbaarheid.
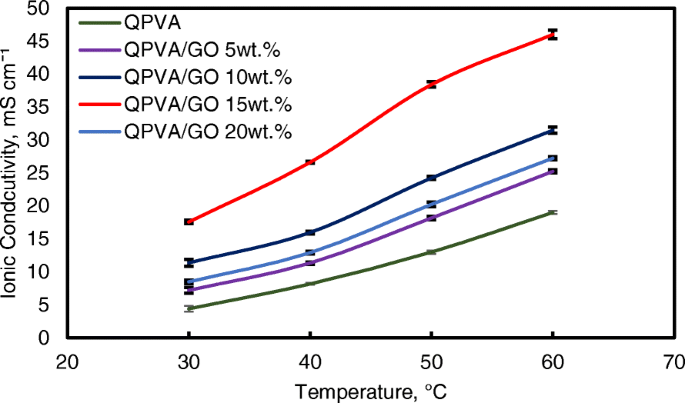
Ionische geleidbaarheidsanalyse van QPVA-membraan en QPVA/GO-composietmembraan bij verschillende temperaturen
De ln σ- en 1000/T-grafieken worden getoond in Fig. 12 met de veronderstelling dat de ionische geleidbaarheid het Arrhenius-gedrag volgt. De activeringsenergie E een van het overgedragen ion in de composietmembranen kan worden verkregen volgens de Arrhenius-vergelijking:
$$ {E}_a=-b\times R $$ (7)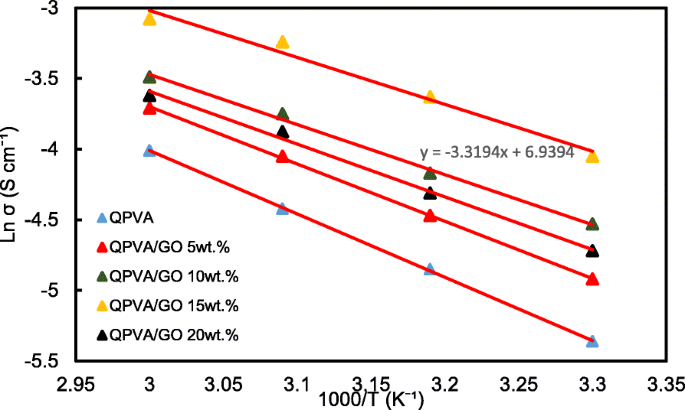
Ln σ vs. 1000/T-plot voor het QPVA/GO-composietmembraan; de lijnen geven de lineaire regressie aan
waar b is de helling van de regressielijn voor de geplotte grafiek (ln σ vs.1000/T) en R staat voor de gasconstante (8.314472 J K −1 mol −1 ). Het QPVA/GO 15 gew.% composietmembraan heeft de laagste activeringsenergie van 18,11 kJ mol −1 in vergelijking met de andere composietmembranen. De GO-belading bij 15 gew.% resulteerde in voldoende aanwezigheid van functionele groepen in het composietmembraan, wat ook een optimale structuur bood voor het effectieve aniontransport om vervolgens bij te dragen aan de vermindering van de activeringsenergie.
Ethanolopname en ethanolpermeabiliteit
Figuur 13 toont de ethanolopname en ethanolpermeabiliteit van de ongerepte QPVA en het verknoopte QPVA/GO (5-20 gew.%) composietmembraan in 2 M ethanol bij 30 °C. Een PVA-eigenschap is de geringe oplosbaarheid ervan in ethanol, wat de crossover van ethanol effectief vermindert [57]. De ethanolopname geeft duidelijk aan dat het QPVA-polymeer minder ethanol absorbeert dan water. Met 20 gew.% GO-lading nam de ethanolopname af met ~ -35% (van 52% door het ongerepte QPVA-membraan tot 34% door het verknoopte QPVA / GO 20-gew.% composietmembraan). Dit gedrag kan worden verklaard door het mogelijke uiterlijk van een driedimensionaal netwerk dat is opgebouwd door het verknopende effect van GA op GO en de polymeermatrix. Deze resultaten zijn belangrijk omdat ze de dimensionele stabiliteit van de composietmembranen onder de ingestelde omstandigheden kunnen aangeven en hun barrière-eigenschappen en ethanolpermeabiliteit kunnen aantonen. De vermindering van de ethanolopname werd voornamelijk geleverd door de optimale GO-lading, die de vorming van een driedimensionaal netwerk tussen GA, GO en PVA verhoogde. Het vrije volume van het polymeercomposiet nam dus af en weerstond dus de ethanolmobiliteitsroute [12, 50, 55]. Afbeelding 13 toont een vergelijkbaar resultaat van ethanolpermeabiliteit voor het ongerepte membraan en composietmembranen. De ethanolpermeabiliteit van het membraan nam af met ~ 85% (van 8,7 × 10 −7 cm 2 s −1 voor het ongerepte membraan tot 1,32 × 10 −7 cm 2 s −1 voor het verknoopte QPVA/GO 20 wt.% composietmembraan). De vermindering van de ethanolpermeabiliteit wordt beïnvloed door het verhogen van het GO-gehalte van het composietmembraan. Het driedimensionale netwerk tussen GA, GO en PVA vormde een compacte structuur die de weerstand van het membraan tegen ethanol-crossover verhoogde. Bovendien werd aan de aanwezigheid van KOH als elektrolyt voldaan aan de vrije volumeruimte in de polymeermatrix [24, 50, 55]. Afbeelding 10b heeft het ethanoltransport in verknoopt QPVA/GO-composietmembraan geïllustreerd. De ethanolpermeabiliteit van de composietmembranen is ook onderzocht in verschillende ethanolconcentraties (2, 4, 6 en 8 M) bij 30 °C, zoals weergegeven in Fig. 14. Het resultaat toonde aan dat de ethanolpermeabiliteit lager is in volgorde van bereik ~ 10 − 7 cm 2 s −1 . De vermindering van de ethanolpermeabiliteit werd toegeschreven aan de aanwezigheid van het hydrofobe gebied wanneer het GO-gehalte toenam, wat functioneert als een crossover-blokkering van ethanol [55, 58]. Bij dezelfde temperatuur vertoonde het verknoopte QPVA/GO-composietmembraan een lagere ethanolpermeabiliteit dan de PVA/fosfowolfraamzuuroplossingen, met verschillende percentages diethyleentriaminepentaazijnzuur. De ethanolpermeabiliteit van het verknoopte QPVA/GO-composietmembraan ligt in het bereik van 1,32–8,7 × 10 −7 cm 2 s −1 , wat lager is dan de vorige studie met QPVA met pyrogeen silica (14–16 × 10 −6 cm 2 s −1 ) in 3 M en 5 M ethanol [40]. De ethanolpermeabiliteit nam toe met toenemende ethanolconcentratie. Dit resultaat is de eerste indicatie dat de nullastspanning van een enkele cel met dit composietmembraan zal afnemen met toenemende ethanolconcentratie.
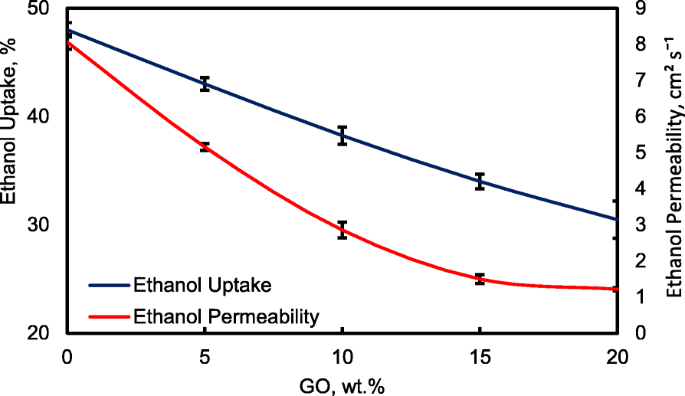
Ethanolopname en ethanolpermeabiliteit van QPVA-membraan en QPVA/GO-composietmembraan bij 30 °C
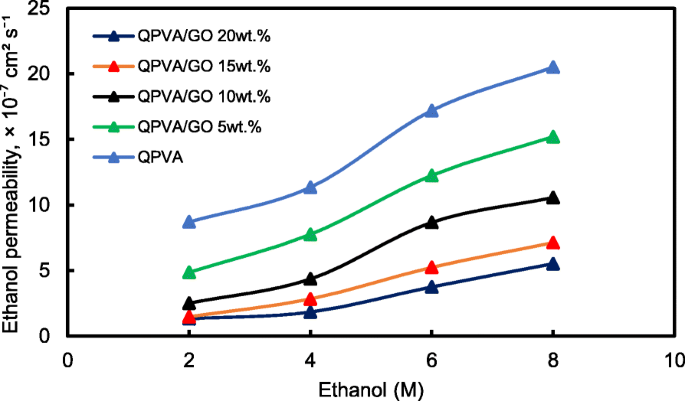
Ethanolpermeabiliteit van QPVA-membraan en QPVA/GO-composietmembraan met verschillende ethanolconcentraties
Het verknoopte QPVA/GO-composietmembraan met de hoogste ionische geleidbaarheid (15 gew.% QPVA/GO) bij 30 °C werd met name waargenomen in de ethanolpermeabiliteitstest voor verschillende temperaturen om de prestaties te beoordelen voor draagbare apparaten in het bereik van 30 °C tot 60 ° C, zoals weergegeven in Fig. 15. De hogere temperatuur leidt tot een hogere ethanolpermeabiliteit als gevolg van de interactie tussen de membraanketens die actiever worden. Bovendien begon het vrije volume in de membranen zich uit te breiden, wat de weerstand tegen ethanol-crossover verminderde. De diffusiecel werd gemeten in een stabiele toestand zonder enige elektrische stroom. Toen het composietmembraan werd toegepast in DEFC's, was de praktische ethanolpermeabiliteit lager vanwege de beweging van het aniontransport tegengesteld aan de richting van de ethanolovergang van de anode naar de kathode [8, 52].
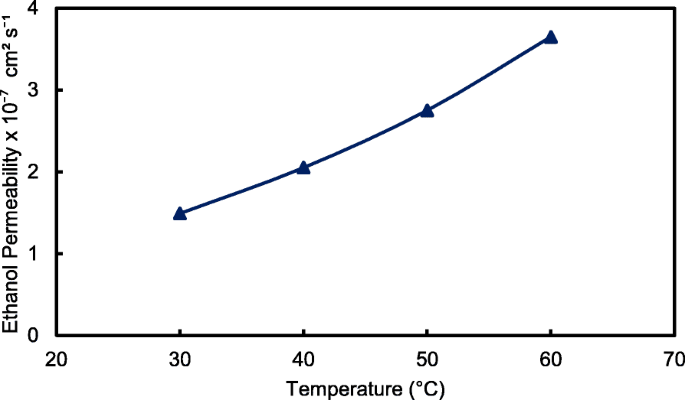
Ethanolpermeabiliteit van QPVA/GO 15 gew.% composietmembraan met verschillende temperatuur
Selectiviteit van het membraan, de passieve alkalische-DEFC prestatie- en duurzaamheidstest
Voor de uitstekende eencellige toepassing van passieve alkaline-DEFC's, moet het membraan een hoge ionische geleidbaarheid en een lage ethanolpermeabiliteit hebben. De verhouding van beide testen wordt de selectiviteitsfactor genoemd. Een uitstekende prestatie van een composietmembraan gaat gepaard met een hogere selectiviteitsfactor [55]. De selectiviteit van de composietmembranen wordt weergegeven in Fig. 16. Het gedrag werd veroorzaakt door de wijziging van QPVA en de introductie van GO met een belasting van 15 wt.% vanwege de hoogste geleidbaarheid en de laagste bereikte ethanolpermeabiliteit. Daarom heeft dit membraan potentieel voor verdere studies in eencellige alkaline-DEFC's. Tabel 3 toont een vergelijking tussen de ionische geleidbaarheid, ethanolpermeabiliteit en selectiviteitsfactor voor op PVA gebaseerde membranen in passieve DEFC-toepassingen bij 30 °C. De huidige studie laat een vergelijkbare prestatie zien met de andere eerdere werken.
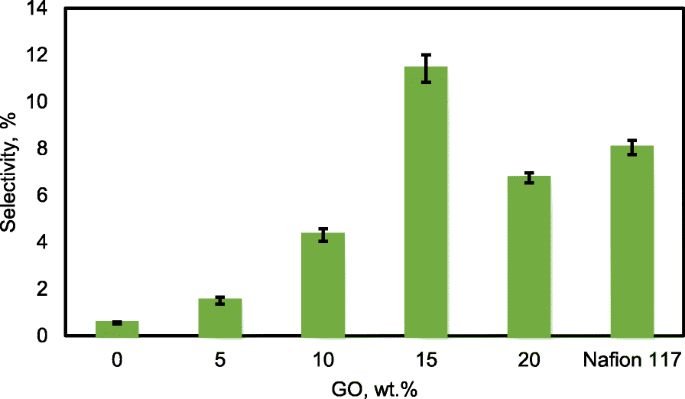
Selectiviteit van QPVA-membraan, QPVA/GO-composietmembraan en Nafion 117
Afbeelding 17 illustreert de polarisatie- en vermogensdichtheidscurves voor passieve alkaline-DEFC's bij 30 °C voor verknoopte QPVA, verknoopte QPVA/GO 15 wt.% en Nafion 117-membranen. Het is duidelijk dat het verknoopte QPVA/GO 15 gew.% composietmembraan een hogere nullastspanning (OCV) van 0,61 V vertoonde, wat kan worden toegeschreven aan de lage ethanolpermeabiliteit in vergelijking met QPVA en Nafion 117, die slechts OCV-waarden van 0,54 bereiken. respectievelijk V en 0,51 V. Het OCV-resultaat was vergelijkbaar met eerdere studie waarbij de op platina gebaseerde katalysator werd gebruikt voor de testprestaties met één cel, in het bereik van 0,4 V tot 0,6 V [15, 59, 60]. De lagere brandstofconcentratie beïnvloedde de OCV-waarde, en Yuen et al. [61] gerapporteerd voor de beste concentratie voor passieve cellen die op platinakatalysator gebaseerd zijn, moet hoger zijn dan 4 M om de optimale celprestaties te bereiken. De maximale vermogensdichtheid van het verknoopte QPVA/GO 15 gew.% composietmembraan was 9,1 mW cm −2 , wat hoger was dan QPVA en Nafion 117 van 5,88 mW cm −2 en 7,68 mW cm −2 , respectievelijk. Deze resultaten bewijzen dat de interactie tussen QPVA en GO plaatsvond en krachtig was om het potentieel van deze membranen te verbeteren.
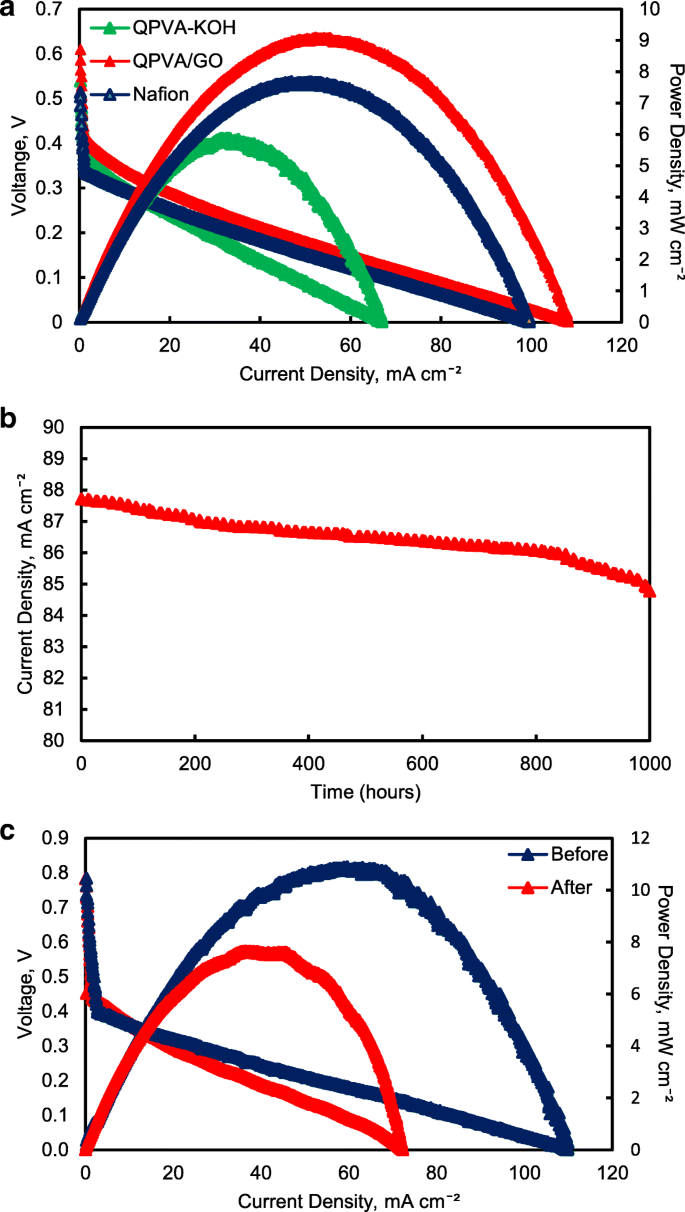
een Celspanning en vermogensdichtheid versus stroomdichtheidscurve verkregen voor de passieve alkaline-DEFC. b Duurzaamheidstest op passieve alkaline-DEFC. c Celspanning en vermogensdichtheid vs. stroomdichtheidscurve voor en na 10.000 min duurzaamheidstest. Anode voeding; 2 M KOH + 2 M ethanol, vathode-voeding; Lucht:een bij 30 °C; b , c bij 60 °C
De prestatie van de celstroomdichtheid tijdens de duurzaamheidstest bij 60 ° C werd getoond in Fig. 17b. De passieve alkaline-DEFC werd gedurende 1000 uur continu gebruikt bij een constante spanning van 0,3 V. De stroomdichtheid van cellen begint met 87,7 mA cm −2 en werd continu langzaam verlaagd tot een bedrijf van 1000 uur en bereikte uiteindelijk ongeveer 84,7 mA cm −2 om 1000 uur. Deze prestatie die gestaag afnam, kan worden veroorzaakt door de toename van de permeabiliteit van ethanol die de verbetering van brandstofcrossover zonder oxidatieactiviteit toeschreef, wat een significant negatief effect had op de prestaties van een enkele cel [62]. De resultaten van de duurzaamheidstest tonen een zeer efficiënte werking van verknoopt QPVA/GO 15 gew.% composietmembraan in een enkele cel, wat de duurzame prestatie tot 1000 uur oplevert.
Afbeelding 17c toont de prestatieverandering in celspanning en vermogensdichtheid van het verknoopte QPVA/GO 15 gew.% composietmembraan voor en na duurzaamheidstests om de permanente degradatie van alkalisch passief-DEFC te evalueren. Wanneer de bedrijfstemperatuur van een enkele cel met 60 °C stijgt, neemt de OCV van de cel toe tot 0,78 V en neemt de maximale vermogensdichtheid van het verknoopte QPVA/GO 15 gew.% composietmembraan toe met 11,4 mW cm −2 . Na de duurzaamheidstest is de maximale vermogensdichtheid teruggebracht tot 7,65 mW cm −2 . De daling van de vermogensdichtheid werd onderworpen aan activeringsverlies van katalysatoractiviteit als gevolg van crossover van ethanol en het verlies van maximale vermogensdichtheid was 32,8%. Het vermogensverlies was afhankelijk van de stroomdichtheid die uit de enkele cel werd getrokken. De waarde van OCV na de test van 1000 uur vertoonde echter geen significante vermindering in vergelijking met vóór de duurzaamheidstest [63].
Tabel 3 geeft een vergelijking van eerder onderzoek op PVA-gebaseerde membranen, toegepast in passieve DEFC's met behulp van een op Pt gebaseerde katalysator. De prestaties in deze studie waren hoger dan die van de passieve DEFC's gerapporteerd door Yang et al. [14] (8 mW cm −2 ) en hoger dan de optimalisatie van commerciële Nafion®117-membranen in passieve DEFC's gerapporteerd door Pereira et al. [5] (1,33 mW cm −2 ). Dit resultaat demonstreerde het succes van onze studie gericht op de prestaties van passieve alkaline-DEFC's met behulp van verknoopt QPVA/GO-composietmembraan als alternatief membraan voor commercieel membraan.
Conclusie
Een nieuw composietmembraan werd bereid door het QPVA-polymeer als matrix en GO als vulmiddel te mengen met GA als verknopingsmiddel. Het bestaan van een quaternaire ammoniumgroep geënt op PVA en gemodificeerd met GO werd bevestigd door FTIR-, XRD- en FESEM-EDX-analyse. Met de vorming van driedimensionale netwerken tussen de polymeermatrix, GO en het verknopingsmiddel, werd de thermische stabiliteit van het composietmembraan verbeterd. De hoogst bereikte ionische geleidbaarheid was 0,046 S cm −1 , samen met een lage ethanolpermeabiliteit van 1,48 × 10 7 cm 2 s −1 . De maximale vermogensdichtheid van 9,1 mW cm −2 was observed for the crosslinked QPVA/GO 15 wt.% composite membrane at 30 °C and 11.4 mW cm −2 bij 60 °C. Therefore, the crosslinked QPVA/GO composite membrane has high potential for use in single-cell DEFC applications. The process of optimizing the composition of QPVA/GO and the replacement of the non-Pt catalyst are expected to further enhance the performance of the QPVA/GO composite membrane.
Afkortingen
- A:
-
Membrane
- AFM:
-
Atoomkrachtmicroscopie
- C:
-
Carbon
- Ca:
-
Concentration of the feeding chamber in cell A
- DEFC:
-
Ethanol fuel cell
- EDX:
-
Energie-dispersieve röntgenspectroscopie
- FESEM:
-
Veldemissie scanning elektronenmicroscoop
- GO:
-
Grafeenoxide
- GTMAC:
-
Glycidyltrimethyl-ammonium chloride
- H2 O2 :
-
Waterstofperoxide
- H2 SO4 :
-
Sulfuric acid
- H3 PO4 :
-
Phosphoric acid
- HCL:
-
Hydrochloric acid,
- KOH:
-
Potassium hydroxide
- L:
-
Distance between the counter electrodes
- L:
-
Thickness of the membrane
- m:
-
Mass (g) of the dried composite membrane.
- Ma :
-
HCl required after equilibrium
- Mb :
-
HCl required before equilibrium
- N:
-
Stikstof
- NaOH:
-
Sodium hydroxide
- O:
-
Oxygen
- P:
-
Ethanol diffusion permeability of the membrane
- PVA:
-
Poly (vinyl alcohol)
- QPVA/GO quaternized:
-
Poly (vinyl alcohol)/graphene oxide
- R:
-
Resistance of the membranes
- t nat :
-
Thickness
- TEM:
-
Transmissie-elektronenmicroscopie
- TGA:
-
Thermogravimetric analysis
- Vb:
-
Volume in each of the diffusion reservoirs
- XRD:
-
Röntgendiffractie
- σ:
-
Proton conductivity
Nanomaterialen
- Titanaat nanobuisjes versierde grafeenoxide nanocomposieten:voorbereiding, vlamvertraging en fotodegradatie
- Invloed van water op de structuur en diëlektrische eigenschappen van microkristallijne en nano-cellulose
- Bioveiligheid en antibacterieel vermogen van grafeen en grafeenoxide in vitro en in vivo
- Grafeenoxide gehybridiseerde nHAC/PLGA-steigers vergemakkelijken de proliferatie van MC3T3-E1-cellen
- Evaluatie van grafeen/WO3 en grafeen/CeO x-structuren als elektroden voor supercondensatortoepassingen
- Een op grafeenoxide gebaseerde fluorescerende aptasensor voor de inschakeldetectie van CCRF-CEM
- Verbeterde protongeleiding en vermindering van de doorlaatbaarheid van methanol via natriumalginaat-elektrolyt-gesulfoneerd grafeenoxide-biomembraan
- Frequentie-gemoduleerde golfdiëlektroforese van blaasjes en cellen:periodieke U-bochten bij de crossover-frequentie
- Lage-temperatuurreductie van grafeenoxide:elektrische geleiding en scanning Kelvin Probe Force Microscopy
- De anionische oppervlakteactieve stof/ionische vloeistoffen geïntercaleerd gereduceerd grafeenoxide voor krachtige supercondensatoren
- Zijn waterstofbrandstofcellen de toekomst van het vervoer?



