Met resveratrol geladen albumine-nanodeeltjes met verlengde bloedcirculatie en verbeterde biocompatibiliteit voor zeer effectieve gerichte pancreastumortherapie
Abstract
Humaan serumalbumine (HSA) is een intrinsiek eiwit en een belangrijke drager die zowel endogene als exogene stoffen door celmembranen transporteert. Hierin hebben we met resveratrol (RV) geladen HSA-nanodeeltjes ontworpen en voorbereid die RGD (arginine-glycine-aspartaat) conjugeren via een polyethyleenglycol (PEG) "brug" (HRP-RGD NP's) voor zeer effectieve gerichte pancreastumortherapie. HRP-RGD NP's hebben een gemiddelde grootte van 120 ± 2,6 nm met een smalle verdeling, een homodisperse bolvorm, een RV-inkapselingsefficiëntie van 62,5 ± 4,21% en een maximale RV-afgifteverhouding van 58,4.2 ±-2,8% bij pH 5,0 en 37 °C. In vitro biocompatibiliteit van RV is verbeterd na coating met HSA en PEG. Confocale fluorescentiebeelden laten zien dat HRP-RGD NP's de hoogste cellulaire opnameratio van 47,3 ± 4,6% hebben in vergelijking met HRP NP's en HRP-RGD NP's met gratis RGD-blokkering, wat wordt toegeschreven aan een RGD-gemedieerd effect. Een celtellingskit-8 (CCK-8)-assay geeft aan dat HRP-RGD NP's zonder RV (HP-RGD NP's) bijna geen cytotoxiciteit hebben, maar HRP-RGD NP's zijn significant cytotoxischer voor PANC-1-cellen vergeleken met vrije RV en HRP NP's op een concentratieafhankelijke manier, met apoptotische morfologie. Bovendien verlengen HRP-RGD NP's met een geformuleerde PEG- en HSA-coating de bloedcirculatie van RV, met een toename van ongeveer 5,43 (t1/2 ). Na intraveneuze injectie in tumordragende muizen bleek het gehalte aan HRP-RGD NP's in tumorweefsel ongeveer 3,01 en 8,1 keer hoger te zijn dan die van respectievelijk HRP NP's en vrije RV. Op basis van deze resultaten werden HRP-RGD NP's gebruikt in een in vivo antikankeronderzoek en vertoonden ze het beste tumorgroeionderdrukkingseffect van alle geteste geneesmiddelen zonder terugval, hoge in vivo biocompatibiliteit en geen significante systemische toxiciteit gedurende 35 dagen behandeling. Deze resultaten tonen aan dat HRP-RGD NP's met verlengde bloedcirculatie en verbeterde biocompatibiliteit hoge antikankereffecten hebben met veelbelovende toekomstige toepassingen in kankertherapie.
Achtergrond
Pancreaskanker is een verwoestende ziekte met een mediane overleving van minder dan 6 maanden en een overlevingspercentage van slechts 6% [1]. De traditionele klinische behandeling voor alvleesklierkanker is chirurgische excisie, radiotherapie en chemotherapie [2, 3]. Deze methoden kunnen echter worden beperkt door ernstige bijwerkingen, zoals de verspreiding van kankercellen na onvolledige excisie, ernstige toxiciteit voor normale cellen tijdens radiotherapie en slechte overlevingspercentages [4]. Hoewel lage doeleffecten en hoge bijwerkingen ook het nut van geneesmiddelen tegen kanker bij chemotherapie hebben beperkt, worden er steeds meer nieuwe chemotherapeutische middelen ontwikkeld. Naast synthetische drugs blijken veel Chinese kruidenextracten effectief te zijn tegen bepaalde kankersoorten. Resveratrol (RV), een natuurlijk extractiemiddel uit vegetatie zoals druiven en sojabonen [5], wordt op grote schaal gebruikt voor de aggregatie van bloedplaatjes en het remmen van vasodilatatie en het verminderen van de bloedviscositeit [6, 7]. En in de afgelopen decennia is ook gevonden dat het geweldige antikankereffecten heeft bij sommige kankers, zoals lever-, borst- en eierstokkanker [8, 9]. Het gebruik van RV als potentieel geneesmiddel tegen kanker heeft echter enkele nadelen voor verdere klinische toepassing, zoals slechte oplosbaarheid, lage bloedcirculatie en gebrek aan selectiviteit [4, 10].
Onder de premisse van het beschermen van de structurele integriteit van het medicijn, heeft de inkapselingsstrategie de interesse van veel onderzoekers gewekt, waarvan is aangetoond dat het effectief is in het overwinnen van enkele van de bovengenoemde nadelen in vergelijking met conventionele "gratis" medicijnen [11]. Het kan bijvoorbeeld de slechte oplosbaarheid en lage biologische beschikbaarheid verbeteren, de snelle nierklaring verlagen en de celselectiviteit verhogen [12]. Momenteel worden veel inkapselingsmethoden gebruikt, zoals door liposomen, op polymeren gebaseerde nanodeeltjes, hydrogels en serumalbumine [13,14,15,16]. Van deze methoden is het gebruik van serumalbumine een van de meest opwindende dragers geworden voor het afleveren van onoplosbare geneesmiddelen tegen kanker. Humaan serumalbumine (HSA), een endogeen eiwit, is niet-toxisch, vertoont niet-immunogeniteit en heeft een grote biocompatibiliteit [17]. Het is op grote schaal gebruikt als een macromoleculaire eiwitdrager voor medicijnafgifte [18]. HSA is dus in staat om de oplosbaarheid van lipofiele geneesmiddelen te verbeteren. Bovendien vergemakkelijkt de aanwezigheid van functionele carboxyl- en aminogroepen op het oppervlak de oppervlaktefunctionalisering voor albumine-nanodeeltjes [19, 20]. Via covalente binding kan het oppervlak van albumine-nanodeeltjes bijvoorbeeld worden versierd met fluorescentiekleurstoffen, doelmoleculen en functioneel RNA [21, 22]. Het kan ook gemakkelijk worden gefunctionaliseerd met hydrofiele polymeren, zoals PEG, om de bloedcirculatie te verlengen [23].
In deze studie wordt HSA gebruikt om lipofiele RV in te kapselen als een nanodrug die aan het oppervlak is gefunctionaliseerd met een tumortargeting-molecuul, arginine-glycine-aspartaat (RGD) via een PEG-"brug" (HRP-RGD NP's). De bereide HRP-RGD NP's vertonen een grote in vitro en in vivo biocompatibiliteit en een verlengde bloedcirculatie. De celopname en in vivo tumorbiodistributie werden ook geëvalueerd om het targetingpotentieel in PANC-1-cellen te valideren. Bovendien werd de gerichte werkzaamheid tegen kanker van HRP-RGD NP's in vitro en in vivo onderzocht. Deze resultaten geven aan dat HRP-RGD NP's een veelzijdig nanoplatform kunnen zijn voor potentiële tumortherapeutische middelen voor gerichte chemotherapie.
Methoden
Materialen
Humaan serumalbumine (HSA, gevriesdroogd poeder, ≥96%), resveratrol (RV, ≥99%), 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide (EDC), fluoresceïne-isothiocyanaat (FITC), Arg–Gly–Asp (RGD, ≥97%), 3-(2-pyridyldithio)propionzuur N -hydroxysuccinimide-ester (SPDP), Hoechst 33258-kleurstof en 4′,6-diamidino-2-fenylindol (DAPI) werden verkregen van Sigma Aldrich (St. Louis, MO, VS). NH2 –PEG2000 –COOH werd gekocht van Seebio Biotech Inc. (Shanghai, China). N -Succinimidyl S -acetylthioacetaat (SATA) werd gekocht bij Pierce Biotech Inc. (Rockford, IL, VS). DMSO, trypsine-EDTA-oplossing, fosfaatbuffer (PBS), foetaal runderserum (FBS), penicilline-streptomycine-oplossing en DMEM-media werden gekocht bij Sigma.
Synthese van HSA-RV-nanodeeltjes
HSA-RV-nanodeeltjes werden gesynthetiseerd door een eenvoudige desolvatiemethode [24]. In detail werd 6 mg RV opgelost in DMSO tot 1 mg/ml en werd gemengd met 10 mg HSA in 1 ml water onder licht roeren, waarbij geharde coacervaten werden gevormd na 6 uur roeren bij kamertemperatuur, en werd vervolgens verwerkt door kruiselings -koppeling met 0,5% glutaaraldehyde (100 μL). Daarna werden de organische oplosmiddelen verwijderd door 1 dag in water te dialyseren, wat resulteerde in de HSA-RV-nanodeeltjes. Blanco HSA-nanodeeltjes werden bereid zoals hierboven vermeld, behalve dat DMSO zonder RV 6 uur werd gemengd met HSA-oplossing.
Synthese en karakterisering van HRP-RGD NP's
HSA-RV-nanodeeltjes werden geconjugeerd met HS-PEG-RGD door de traditionele cross-linker SPDP zoals beschreven in de literatuur [25]. In het kort, 20 mg NH2 –PEG2000 –COOH werd gedurende 3 uur behandeld met 2 mg SATA en gezuiverd door te ontzouten. De resulterende SATA-PEG werd gedurende 3 uur toegevoegd aan een 10 mg RGD-peptide en 8 mg EDC. De SATA-beschermde PEG-RGD werd vervolgens gedurende 3 uur in reactie gebracht met 1 ml hydroxylamine in natriumfosfaat. Na gezuiverd door te ontzouten, kreeg het de HS-PEG-RGD. Vervolgens werd de verkregen HS-PEG-RGD geconjugeerd met HSA-RV-nanodeeltjes via disulfidebindingen. In het kort, de aminogroepen van de HSA-RV-nanodeeltjes werden eerst geactiveerd door SPDP en vervolgens opnieuw gesuspendeerd in 10 ml PBS en gedurende 24 uur gereageerd met overmaat HS-PEG-RGD of HS-PEG. De resulterende oplossing werd herhaald gewassen met PBS en gefiltreerd door een Millipore-filter (100 kDa) om alle resterende PEG-RGD en andere organische oplosmiddelen te verwijderen, resulterend in HRP-RGD NP's. De morfologie en grootte van de nanodeeltjes werden gedetecteerd door respectievelijk scanning-elektronenmicroscopie (SEM, Philips XL-30 FEG, Eindhoven, Nederland) en een Zetasizer Nano ZS-systeem (Malvern Instruments, Malvern, VK). Absorptiespectra werden verkregen door een UV-Vis-spectrofotometer (UV1800, Shimadzu, Japan). Fluorescentiespectra werden geregistreerd door een fluorescentiespectrometer (F-4500, Hitachi, Japan).
Drugs laden en vrijgeven
Zes milligram RV werd opgelost in DMSO tot 1 mg/ml en werd gemengd met 10 mg HSA in 1 ml water onder licht roeren, waarbij geharde coacervaten werden gevormd na 6 uur roeren bij kamertemperatuur, en werd vervolgens verwerkt door verknoping met 0,5% glutaaraldehyde (100 L). Daarna werden de organische oplosmiddelen en vrije RV verwijderd door 1 dag in water te dialyseren. Het dialysaat werd gebruikt om de vrije RV te kwantificeren met een UV-Vis-spectrometer bij 306 nm volgens een kalibratiecurve. De hoeveelheid geneesmiddel in HRP-RGD NP's was de totale toegevoegde RV minus de hoeveelheid vrije RV.
RV-afgifte van HRP-RGD NP's werd gedetecteerd via een dynamische dialysetechniek (dialysezak met een cutoff Mw van 8-12 kDa) bij respectievelijk pH 5,0, 7,4 en 9,0 PBS bij 37 ° C. De geneesmiddelconcentratie werd berekend met behulp van een standaard kalibratiecurve. De inkapselingsefficiëntie = W 1 /W 2 × 100%, waarbij W 1 staat voor het gewicht van RV in HRP-RGD NP's, en W 2 is het gewicht van RV toegevoegd. Cumulatieve afgifte = W een /W b × 100%, waarbij W een staat voor de hoeveelheid vrijgekomen RV, en W b is de totale RV die aanwezig is in HRP-RGD NP's.
In vitro hemolyse-assay
In vitro hemolyse-assay werd uitgevoerd zoals beschreven in eerder werk [26]. In detail werden 0,2 ml rode bloedcellen (RBC's, in PBS) gemengd met 0,8 ml HRP-RGD NP's (in PBS) in vooraf bepaalde concentraties (10, 50, 100 en 200 μg / ml). RBC's geïncubeerd met gedeïoniseerd water of PBS werden respectievelijk ingesteld als positieve of negatieve controle. Na 3 uur geïncubeerd bij 37 ° C, werd de bovenstaande set suspensies gedurende 1 minuut bij 10.000 tpm gecentrifugeerd en de absorptie van de supernatanten bij 541 nm werd gevolgd door een UV-Vis-spectrometer. Hemolytische verhouding = (ODt − ODnc )/(ODpc − ODnc ) × 100%, waarbij ODt , ODpc , en ODnc zijn respectievelijk de absorptie van het supernatant van het testmonster, positieve en negatieve controles.
Celcultuur
Humane pancreastumor PANC-1-cellen werden gekocht van de Cell Bank of Type Culture Collection van de Chinese Academie van Wetenschappen (Shanghai, China) en gekweekt in DMEM-media aangevuld met 10% FBS en 1% penicilline-streptomycine in een bevochtigde incubator (5% CO2 ) bij 37 °C.
Cellulaire opname
Voor cellulaire opname werd FITC gebruikt om de HRP-RGD NP's te labelen. PANC-1-cellen hechtten zich aan glasplaatjes in platen met 6 putjes en werden respectievelijk 5 uur geïncubeerd met HRP NP's, HRP-RGD NP's + gratis RGD-blokkering en HRP-RGD NP's in dezelfde concentratie van gelabeld FITC. En vervolgens werden de cellen driemaal gewassen met PBS en gefixeerd met 0, 2 ml glutaaraldehyde, gevolgd door kleuring met DAPI gedurende 10 minuten. De fluorescentiebeelden van cellen werden vastgelegd door de laser scanning confocale microscoop (Leica TCS SP8 CARS, Wetzlar, Duitsland).
Bovendien werden de opnameverhoudingen van HRP NP's, HRP-RGD NP's + vrije RGD-blokkering en HRP-RGD NP's bij dezelfde concentratie van gelabelde FITC door PNAC-1-cellen geanalyseerd met behulp van flowcytometrie (FCM, FACSCalibur, FACSCanto II) door FITC-fluorescentie te meten. Voor elke FCM-analyse werden tienduizenden cellen geregistreerd. De FITC-fluorescentie werd opgewekt met een laser van 488 nm.
In vitro cytotoxiciteit
De cytotoxiciteit van HP-RGD NP's, de drager van RV, werd uitgevoerd met behulp van een standaard celtellingskit-8 (CCK-8)-assay (Bestbio, China). PNAC-1 cellen (1 × 10 5 cellen / ml, 0,5 ml) werden gezaaid in een plaat met 96 putjes en 24 uur gekweekt. Na het weggooien van de oude media werden verse media met 10, 50, 100 en 200 g / ml HRP-RGD NP's 24 uur geïncubeerd met PNAC-1-cellen. PBS werd gebruikt om de cellen driemaal mild te wassen. Een 100 μL CCK-8-werkoplossing (10% CCK-8 +-90% DMEM) werd vervolgens aan elk putje toegevoegd, gevolgd door incubatie bij 37 ° C gedurende 0,5 uur. De absorptiewaarde bij 450 nm werd gedetecteerd met behulp van een microplaatlezer (Infinite 200 Pro, Tecan, Oostenrijk). Verder werd de in vitro werkzaamheid tegen kanker van de RV (opgelost in DMSO), HRP NP's en HRP-RGD NP's met dezelfde RV-concentratie tegen PNAC-1-cellen geëvalueerd met de hierboven genoemde CCK-8-assay. Alle experimenten werden in viervoud uitgevoerd. Bovendien werd het morfologische onderzoek op apoptose gedetecteerd door Hoechst 33258-kleuring. De fluorescentie van Hoechst 33258 in cellen werd waargenomen en vastgelegd met een confocale laser scanning microscoop.
Dierenmodel
Balb / c naakte muizen, 4-5 weken, werden gekocht bij de Shanghai Slac Laboratory Animal Co. Ltd. (Shanghai, China). Alle dierproeven werden uitgevoerd in overeenstemming met de gids voor de verzorging en het gebruik van proefdieren en goedgekeurd door het Taishan Medical University Administration Office of Laboratory Animal. Subcutane tumor-xenotransplantaatmodellen werden vastgesteld in het rechterachtergebied van muizen door 1 × 10 6 te injecteren PNAC-1-cellen per muis, en wanneer de tumoren een volume van ongeveer 80 mm vertoonden 3 , werden deze muizen willekeurig verdeeld in verschillende groepen (n = 5) voor verder gebruik.
Bloedcirculatie en tumorbiodistributie
De normale muizen werden intraveneus geïnjecteerd met RV, HRP NP's en HRP-RGD NP's. Daarna werden bloedmonsters verzameld op verschillende tijdstippen van de orbitale plexus. Elk bloedmonster werd opgelost in 900 μL lysisbuffer. De concentratie van RV, HRP NP's en HRP-RGD NP's in het bloed werd bepaald door RV-absorptiespectra van elk opgelost bloedmonster door een UV-Vis-spectrometer. De monsterconcentraties worden gedefinieerd als het percentage geïnjecteerde dosis per gram weefsel (ID%/g).
Biodistributie in tumor werd uitgevoerd in tumordragende muizen. De tumorweefsels werden gewogen en 's nachts verteerd door middel van aqua regia-oplossing op 24 uur na intraveneuze injectie van respectievelijk RV, HRP NP's en HRP-RGD NP's. De concentratie van RV, HRP NP's en HRP-RGD NP's in de tumor werd bepaald door RV-absorptiespectra van elk opgelost tumorweefsel met een UV-Vis-spectrometer. De monsterconcentraties worden gedefinieerd als het percentage geïnjecteerde dosis per gram weefsel (ID%/g).
In vivo werkzaamheid tegen kanker
De muizen van verschillende groepen werden intraveneus geïnjecteerd met zoutoplossing, RV, HRP NP's en HRP-RGD NP's (de dosis gelijk aan RV, n = 5, 10 mg/kg). Tijdens de behandeling werden de tumorgroottes en het lichaamsgewicht van de tumordragende muizen om de 3 dagen gecontroleerd. Het tumorvolume werd berekend met de formule:V = (lengte × breedte 2 )/2. Relatief tumorvolume = V /V 0 , waar V 0 was het tumorvolume voorafgaand aan de initiële behandeling.
Histologisch onderzoek
Gezonde naakte Balb/c-muizen van verschillende groepen werden intraveneus geïnjecteerd met zoutoplossing (controle), RV, HRP NP's en HRP-RGD NP's (de dosis gelijk aan RV, n = 5, 5 mg/kg). Na 35 dagen werden muizen opgeofferd en het hart, de lever, de milt, de long en de nier werden verzameld. De verkregen hoofdorganen werden overnacht gefixeerd met 4% paraformaldehyde. Daarna werden deze organen gedehydrateerd in 25% sucrose, in plakjes van 5 m gesneden en gekleurd met hematoxyline en eosine (H&E). De gekleurde secties werden afgebeeld onder een omgekeerde fasecontrastmicroscoop.
Resultaten en discussie
Synthese en karakterisering van HRP-RGD NP's
Volgens een eenvoudige desolvatiemethode [24] werd RV ingekapseld door HSA, wat resulteerde in HSA-RV-nanodeeltjes. Daarna werd het oppervlak van HSA-RV-nanodeeltjes covalent gefunctionaliseerd met HS-PEG-RGD door de traditionele cross-linker SPDP [25], waarbij nanocomposiet HRP-RGD NP's werden gevormd. De HRP NP's en HRP-RGD NP's vertoonden een unimodale en smalle deeltjesgrootteverdeling (Fig. 1a, b). Na conjugeren van RGD op het oppervlak van HRP NP's, nam de gemiddelde grootte van nanodeeltjes toe van 113 ± 3.1 nm tot 120 ± 2.6 nm. Bovendien vertoonden HRP NP's en HRP-RGD NP's een homodisperse bolvormige morfologie (Fig. 1c, d).
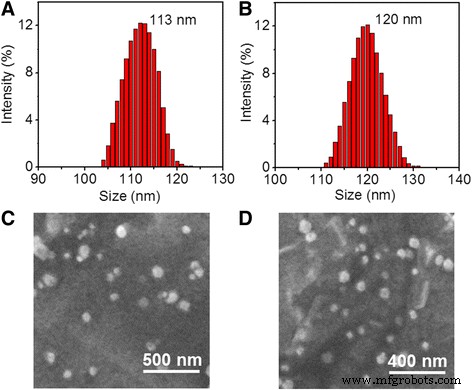
Deeltjesgrootteverdeling van HRP NP's (a ) en HRP–RGD NP's (b ). SEM-beelden van HRP NP's (c ) en HRP–RGD NP's (d )
UV-Vis- en fluorescentiespectra werden genomen om de aanwezigheid van RV in HRP-RGD NP's te bevestigen. Zoals getoond in figuur 2a, vertoonden HRP NP's en HRP-RGD NP's absorptiepieken voor RV bij 304 nm, wat wijst op de aanwezigheid van RV in beide nanodeeltjes. Bovendien vertoonden HRP NP's en HRP-RGD NP's RV-fluorescentiesignalen bij een excitatiegolflengte van 325 nm, wat consistent is met de fluorescentiespectra van RV (figuur 2b). Deze resultaten tonen aan dat RV zijn optische eigenschappen behoudt na conjugatie aan HRP NP's en HRP-RGD NP's.
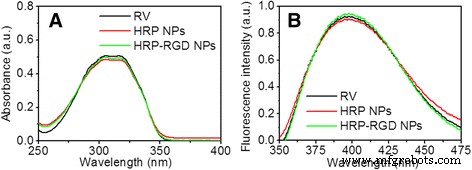
een De absorptiespectra van vrije RV, HRP NP's en HRP-RGD NP's. b De fluorescentiespectra van vrije RV, HRP NP's en HRP-RGD NP's
RV laden en vrijgeven
Figuur 3a toont de veranderingscurve van de inkapselingsefficiëntie van RV in HRP-RGD NP's bij toenemende RV-concentratie. De maximale RV EE van HRP-RGD NP's die werd verkregen was 62, 5 ± -4, 21%. Bovendien vertoonden HRP-RGD NP's, zoals te zien is in figuur 3b, de hoogste RV-afgiftesnelheid van 58,4,2 ± -2,8% na 60 uur bij 37 ° C en pH 5,0 vergeleken met de afgiftesnelheid verkregen bij pH 6,5, pH 7,4, en pH 9,0 bij 37 °C. Er is gemeld dat de normale pH van het bloed 7,4 is, terwijl tumorweefsel licht zuur is [27]. Dit blijkt een gunstig kenmerk te zijn van het gebruik van HRP-RGD NP's bij tumortherapie.
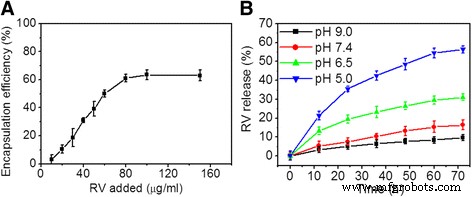
een RV-inkapselingsefficiëntie als de functie van toegevoegde RV-concentraties. b In vitro afgifteprofiel van RV van HRP-RGD NP's in pH 5,0, 6,5, 7,4 en 9,0 bij 37 °C
In vitro biocompatibiliteit
Figuur 4a, b toont afbeeldingen van DMSO opgeloste RV en HRP-RGD NP's in PBS bij 4 ° C na 7 dagen. De eerste vertoont vaste materie zoals naaldvormig kristal, terwijl de laatste veel micro- en homodisperse bolvormige deeltjes heeft, wat wijst op de verbeterde stabiliteit van RV na inkapseling door HSA-nanodeeltjes. Verder vertoonde de gemiddelde grootte van HRP-RGD NP's in water, DMEM, PBS en FBS bijna geen variatie gedurende 4 weken (Fig. 4c), wat de hoge colloïdale stabiliteit van HRP-RGD NP's aantoont, hoogstwaarschijnlijk toegeschreven aan de PEG en HSA-inkapseling.
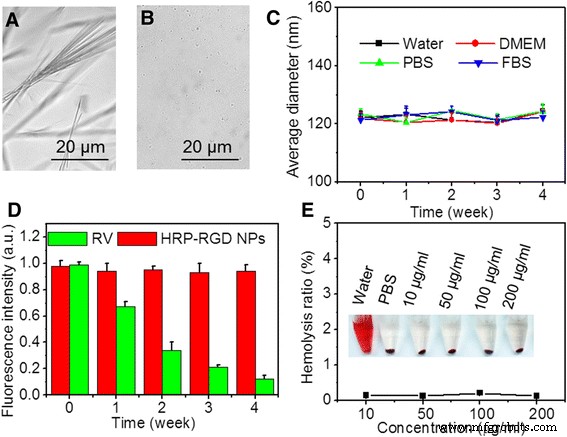
Het microscoopbeeld van a gratis RV (opgelost in DMSO) in PBS en b HRP-RGD NP's in PBS na 7 dagen. c Colloïde stabiliteitstest van HRP-RGD NP's in verschillende media (water, DMEM, PBS en FBS). d De RV-fluorescentiestabiliteit in HRP-RGD NP's na 4 weken. e Hemolyseverhouding van RBC's na 1 uur incubatie met HRP-RGD NP's in verschillende concentraties. De inzet toont de foto van RBC's die zijn blootgesteld aan gedestilleerd water, PBS en HRP-RGD NP's met verschillende concentraties gevolgd door centrifugatie
Figuren 4d tonen de fluorescerende stabiliteit van RV en HRP-RGD NP's in waterige oplossing bij 4 ° C. Na 4 weken opslag bleef de RV-fluorescentie-intensiteit van HRP-RGD NP's meer dan 96,8% van de oorspronkelijke intensiteit; de fluorescentie van RV daalde echter snel tot 12,1% van de initiële intensiteit, waarschijnlijk als gevolg van RV-precipitatie uit de oplossing [10], wat verder wijst op de stabiliteit van HRP-RGD NP's in vergelijking met vrije RV. Bovendien werd, zoals getoond in Fig. 4e, geen significant hemolyse-fenomeen gedetecteerd voor met HRP-RGD NP's behandelde RBC's onder 200 μg / ml, vergelijkbaar met die van de met negatieve controle PBS behandelde groep, wat de uitstekende hemocompatibiliteit van HRP-RGD NP's illustreert . Deze resultaten suggereren dat HSA-inkapseling de stabiliteit en in vitro biocompatibiliteit van RV verbeterde, wat gunstig is voor biomedische toepassingen.
Cellulaire opname
HRP NP's en HRP-RGD NP's werden gelabeld door FITC. Zoals getoond in Fig. 5a, vertoonden de kernen blauwe fluorescentie, die werden gekleurd door DAPI. Een intense groene fluorescentie (FITC-signaal) werd waargenomen in het perinucleaire gebied van PANC-1-cellen die waren behandeld met HRP-RGD NP's, wat aantoont dat een voldoende hoeveelheid HRP-RGD NP's het cytoplasma binnenkwamen. Daarentegen werd zeer weinig groene fluorescentie aangetoond in met HRP NP's behandelde PANC-1-cellen. Bovendien vertoonden PANC-1-cellen die waren voorbehandeld met vrij RGD ook milde groene fluorescentie, waarschijnlijk toegeschreven aan de RGD-receptor op het PANC-1-oppervlak die werd geblokkeerd door vrij RGD. De cellulaire opnameverhouding van de nanodeeltjes werd gedetecteerd door FCM, die 16,2 ± 4,9%, 7,1 ± 5,1% en 58,5 ± 3,5% was voor HRP NP's, HRP-RGD NP's met RGD-blokkering en met HRP-RGD NP's behandelde PANC- 1-cellen, respectievelijk (Fig. 5b). Deze resultaten tonen aan dat het doelmolecuul RGD de zeer efficiënte opname van HRP-RGD NP's door PANC-1-cellen kan vergemakkelijken [28, 29].
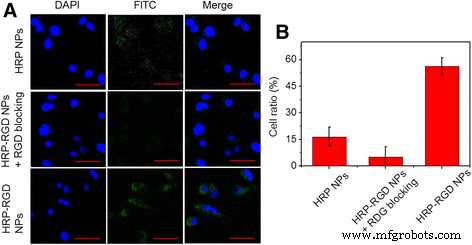
een Confocale fluorescentiebeelden van PANC-1-cellen na incubatie met HRP NP's, HRP-RGD NP's met RGD-blokkering en HRP-RGD NP's gelabeld door FITC. Groen en blauwe kleuren vertegenwoordigen respectievelijk FITC-fluorescentie en DAPI-gekleurde celkernen. Schaalbalk = 20 μm. b De kwantitatieve cellulaire opname van PANC-1-cellen naar HRP NP's, HRP-RGD NP's met RGD-blokkering en HRP-RGD NP's door flowcytometrie
In vitro cytotoxiciteit
Figuur 6a toont de cytotoxiciteit van HP-RGD NP's met een concentratiebereik van 0-200 μg/ml volgens CCK-8-assay, waarbij de levensvatbaarheid van PANC-1-cellen boven 90% werd gehouden. Er werd gesuggereerd dat niveaus van RV-drager HP-RGD NP's onder 200 μg / ml geen significante cytotoxiciteit hadden. Bovendien werd ook het antikankereffect van HRP-RGD NP's in vitro geëvalueerd. Figuur 6b laat zien dat vrije RV, HRP NP's en HRP-RGD NP's bij RV-concentraties tussen 0 en 50 μg/ml op een dosisafhankelijke manier een afname van de levensvatbaarheid van de cellen veroorzaakten. In vergelijking met vrije RV- en HRP-NP's, kunnen HRP-RGD-NP's resulteren in de grootste afname van de levensvatbaarheid van cellen onder alle testconcentraties, waarschijnlijk vanwege de stabiliteit en RGD-targeting-effecten van HRP-RGD-NP's op PANC-1-cellen [30, 31] . Bovendien werden de kernen van PANC-1-cellen behandeld met vrije RV, HRP NP's en HRP-RGD NP's (allemaal bij 30 g / ml RV) gekleurd door Hoechst 33258 en waargenomen onder confocale fluorescentiemicroscoop. De met HRP NP's en HRP-RGD NP's behandelde cellen vertoonden de aanwezigheid van pyknotische kernen, consistent met met RV behandelde cellen (Fig. 6c-f), wat aangeeft dat het celdoodtype hoogstwaarschijnlijk apoptose is [32].
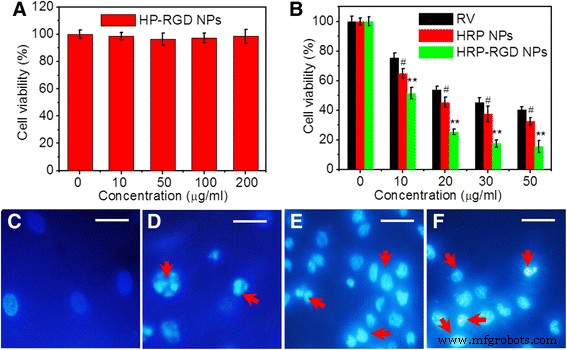
een Cellevensvatbaarheid van PANC-1-cellen na behandeling met HP-RGD NP's gedurende 24 uur. b Levensvatbaarheid van cellen van PANC-1-cellen na incubatie met verschillende concentraties van RV, HRP NP's en HRP-RGD NP's. De kern van PANC-1-cellen behandeld met PBS (c ), camper (d ), HRP NP's (e ), HRP–RGD NP's (f ) gekleurd door Hoechst 33258 na behandeling gedurende 24 uur. De beelden zijn opgenomen met een digitale camera. Schaalbalk = 20 μm. Rode pijlen vertegenwoordigen de kernen pyknotische cellen
Bloedcirculatie en tumorbiodistributie
Figuur 7a toont de bloedcirculatietijd van vrije RV, HRP NP's en HRP-RGD NP's na intraveneuze injectie in muizen. Het is te zien dat HRP NP's en HRP-RGD NP's bijna dezelfde halfwaardetijd hebben (t 1/2 ) van 7,5 ± 0,5 h en t 1/2 = 6,57 ± 0,9 uur, respectievelijk. Terwijl vrije RV snel uit het bloedcirculatiesysteem werd verwijderd en t 1/2 = 1,21 ± 0,09 uur. HRP-RGD NP's verlengden de bloedcirculatietijd van RV, met een toename van ongeveer 5,43 (t 1/2 ). Bovendien was 24 uur na injectie met de nanodeeltjes het gehalte aan RV in het tumorweefsel van de met HRP-RGD NP's behandelde groep ongeveer 3,01 en 8,1 keer hoger dan die van de met HRP NP's en vrije RV behandelde groepen , respectievelijk (Fig. 7b). Deze resultaten geven aan dat HSA- en PEG-inkapseling de circulatietijd zou kunnen verlengen om de eliminatie van RV te verminderen en een significant selectief accumulatievermogen in tumorweefsel te laten zien [33, 34], waarschijnlijk vanwege de verbeterde permeabiliteit en retentie (EPR) en de RGD-targeting effect [35].
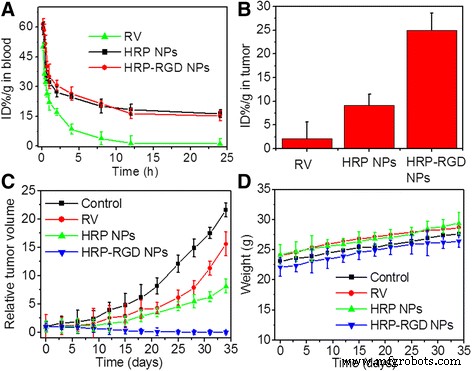
een Bloedcirculatiecurven van vrije RV, HRP NP's en HRP-RGD NP's bij muizen na intraveneuze injectie bepaald door de RV-absorptie van verdund weefsellysaat. b Inhoud van RV in tumor 24 uur na behandeling met RV, HRP NP's en HRP-RGD NP's. c Het relatieve tumorvolume van tumordragende muizen na intraveneuze injectie met zoutoplossing (controle), RV, HRP NP's en HRP-RGD NP's. d Lichaamsgewicht van tumordragende muizen na intraveneuze injectie met zoutoplossing (controle), RV, HRP NP's en HRP-RGD NP's
In vivo werkzaamheid tegen kanker
Figuur 7c toont de antikankerefficiëntie van vrije RV, HRP NP's en HRP-RGD NP's bij dezelfde concentratie van RV na intraveneuze staartinjectie. Als controle werden muizen behandeld met zoutoplossing. Met HRP-RGD NP's behandelde muizen vertoonden een significant onderdrukte tumorgroei en geen terugval na 35 dagen behandeling. Terwijl vrije RV, met HRP NP's behandelde groepen, vergelijkbaar met de controlegroep, een steeds toenemende tumorgroei vertoonden. Zoals verwacht nam het lichaamsgewicht van de muizen in alle groepen niet significant af gedurende 35 dagen behandeling (Fig. 7d). Bovendien werd de in vivo systemische toxiciteit verder geëvalueerd door H&E-kleuring van de belangrijkste organen (hart, lever, milt, long en nier) na 35 dagen behandelingen (Fig. 8). Er werd geen merkbare weefseltoxiciteit of -afwijking gevonden in de overeenkomstige weefsel-H&E-kleuringsbeelden van alle geteste groepen, wat de in vivo veiligheid van HRP-RGD NP's voor biomedische toepassingen verder garandeerde.
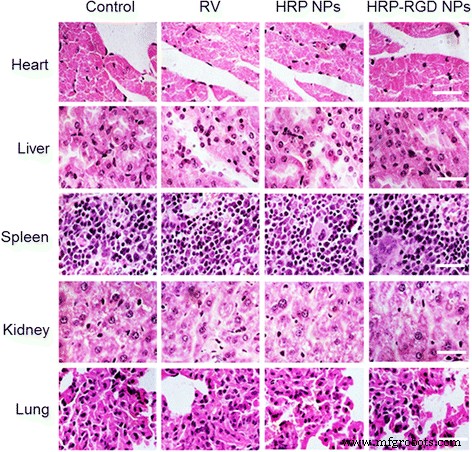
De representatieve HE-kleuring beelden van het hart, de lever, de milt, de nieren en de longen. Schaalbalk = 100 μm
Conclusies
Samenvattend hebben we geïllustreerd hoe HRP-RGD NP's kunnen worden gebruikt als een zeer effectief therapeutisch middel dat gericht is op pancreastumoren. Er werd aangetoond dat HRP-RGD NP's verbeterde colloïdale stabiliteit en biocompatibiliteit in vitro vertoonden in vergelijking met vrije RV. RGD als doelmolecuul bevorderde de zeer efficiënte celopname van HRP-RGD NP's. Met de aanwezigheid van PEG en HSA vertoonden HRP-RGD NP's een aanzienlijk langere circulatietijd die de korte bloedcirculatie van vrije RV kan overwinnen. Op basis van de RGD-targeting was het gehalte aan HRP-RGD NP's in tumorweefsel meer dan dat van vrije RV en HRP NP's. Bovendien toonden in vitro en in vivo studies aan dat in vergelijking met vrije RV en HRP NP's, HRP-RGD NP's een uitstekend antikankereffect hebben dat waarschijnlijk wordt veroorzaakt door apoptose. Eindelijk vertoonden HRP-RGD NP's een hoge biocompatibiliteit en geen significante systemische toxiciteit in vivo gedurende een behandeling van 35 dagen. Deze resultaten tonen aan dat HRP-RGD NP's een veelbelovend middel voor tumorchemotherapie kunnen zijn in toekomstige biomedische toepassingen.
Afkortingen
- CCK-8:
-
Celtelkit-8
- FBS:
-
Foetaal runderserum
- FITC:
-
Fluoresceïne isothiocyanaat
- HSA:
-
Human serum albumin
- PBS:
-
Phosphate buffer
- PEG:
-
Polyethylene glycol
- RGD:
-
Arginine–glycine–aspartate
- RV:
-
Resveratrol
Nanomaterialen
- Multifunctionele gouden nanodeeltjes voor verbeterde diagnostische en therapeutische toepassingen:een overzicht
- Nanodeeltjes voor kankertherapie:huidige vooruitgang en uitdagingen
- Gemodificeerd hypervertakte polyglycerol als dispergeermiddel voor groottecontrole en stabilisatie van gouden nanodeeltjes in koolwaterstoffen
- Synthese en in vitro prestaties van met polypyrrool gecoate ijzer-platina nanodeeltjes voor fotothermische therapie en foto-akoestische beeldvorming
- 5-aminolevulinezuur-squaleen nanoassemblages voor tumorfotodetectie en therapie:in vitro studies
- Silica diatomeeënschalen op maat gemaakt met Au-nanodeeltjes maken gevoelige analyse van moleculen mogelijk voor biologische, veiligheids- en milieutoepassingen
- Eenvoudige synthese van ligandvrije iridium-nanodeeltjes en hun in vitro biocompatibiliteit
- Artesunaat-geladen en nabij-infrarood kleurstof-geconjugeerde albumine nanodeeltjes als zeer efficiënte tumor-gerichte foto-chemo theranostic agent
- Decoratie van nanoblaasjes met pH (laag) insertiepeptide (pHLIP) voor gerichte toediening
- Goed uitgelijnde TiO2-nanobuisjes met Ag-nanodeeltjes voor zeer efficiënte detectie van Fe3+-ionen
- Blootstelling aan titaniumdioxide-nanodeeltjes tijdens de zwangerschap Veranderde maternale darmmicrobiota en verhoogde bloedglucose van ratten



