Anti-Epcam Aptamer (Syl3c)-gefunctionaliseerd liposoom voor gerichte toediening van doxorubicine:in vitro en in vivo antitumoronderzoek bij muizen met C26 coloncarcinoom
Abstract
In deze studie hebben we aan het oppervlak gefunctionaliseerd gePEGyleerd-nanoliposomaal doxorubicine (DOX) met anti-EpCAM (epitheelceladhesiemolecuul) aptameer via post-insertie van anti-EpCAM aptameer-geconjugeerd DSPE-mPEG2000 in Caelyx® (ED-lip). De grootte, lading, afgifteprofiel en cytotoxiciteit en cellulaire opname van formulering werden bepaald. De karakterisering van de ED-lip toonde de lichte toename in grootte en PDI samen met de afname in zeta-potentiaal, wat aangaf dat post-insertie efficiënt werd uitgevoerd. De resultaten van flowcytometrie en fluorescentiemicroscopie hebben aangetoond dat ED-lip de celopname op C26-cellijn verhoogde in vergelijking met Caelyx®. De ED-lip had ook meer cytotoxische effecten dan Caelyx®, wat wees op de werkzaamheid van anti-EpCAM-aptameer als targeting-ligand. De farmacokinetische en weefselbiodistributie van formuleringen bij muizen met C26-tumoren toonde aan dat ED-lip het distributieprofiel van DOX niet beïnvloedde in vergelijking met Caelyx® in diermodel. Bovendien verbeterde ED-lip effectief de tumoraccumulatie van DOX en bevorderde het de overleving van dieren in vergelijking met Caelyx®. Deze resultaten suggereren dat de functionalisering van Caelyx® met anti-EpCAM aptamer veelbelovend is bij de behandeling van kanker en nader onderzoek verdient.
Inleiding
Nano-medicijnafgiftesystemen (NDDS's) met de grootte van 100-200 nm worden passief geaccumuleerd in de micro-omgeving van de tumor via een verbeterd permeabiliteits- en retentie-effect (EPR). Dit gebeurt door de losse endotheliale voering en zwakke lymfedrainage. Recente gegevens gaven echter aan dat slechts minder dan 1% van het toegediende geneesmiddel de tumorplaats kon bereiken [1]. Gebrek aan het vermogen om door te dringen in de dichte extracellulaire matrix (ECM) van de tumor, terugkeer van het vrijgekomen medicijn in de circulatie en heterogeniteit van tumoren zijn de redenen die verantwoordelijk zijn voor dit falen [2]. Er zijn verschillende strategieën gebruikt om tumoraccumulatie van NDDS's te verbeteren met behulp van endogene en exogene stimuli [3]. Deze NDDS's zouden kunnen reageren op de exogene stimuli zoals licht en kunnen worden gebruikt bij tumorbeeldvorming [4]. Er zijn veel verschillende anorganische nanomaterialen die kunnen worden gebruikt als middelen tegen kanker [5, 6]. In het geval van anorganische nanomaterialen moet echter aandacht worden besteed aan hun toxiciteit en milieuveiligheid [7,8,9,10,11].
Actieve gerichte afgifte is een belangrijke benadering die NDDS's helpt om therapeutische middelen efficiënter af te leveren aan de tumoren en de blootstelling aan niet-doelweefsels te minimaliseren [12, 13]. Een ideaal richtmiddel voor gerichte afgifte is een molecuul dat affiniteit heeft met de celoppervlakte-eiwitten of receptoren die worden opgereguleerd door bepaalde cellen of weefselcomponenten [14].
Het epitheliale celadhesiemolecuul (EpCAM) is een transmembraanglycoproteïne dat wordt beschouwd als een kandidaat-ligand voor actieve targeting. Recente bevindingen gaven aan dat de EpCAM normale gezonde epitheelcellen met lage expressie heeft, terwijl de expressie in kankercellen in hogere niveaus wordt (tot 1000-voudig) [15,16,17]. Tijdens de ontwikkeling van kanker verandert het expressiepatroon van EpCAM van basaal en basolateraal membraan in normaal epitheel naar het apicale oppervlak in tumorepitheelcellen [18]. Deze differentiële expressie maakt EpCAM tot een zeer interessant ligand voor medicijnafgifte, wat de therapeutische index van medicijn zou kunnen verbeteren [19].
EpCAM is aangetoond als kankerstamcel (CSC) of tumor initiërende cel (TIC) marker, waarvan de expressie bij kanker gerelateerd is aan de slechte prognose [20]. CSC of TIC zijn cellen die zichzelf vernieuwen, het vermogen hebben om meer cellen van hetzelfde type te produceren, die een sleutelrol spelen bij tumorontwikkeling en metastase [21]. De overexpressie van EpCAM is gemeld in CSC van verschillende solide tumoren [22]. Onlangs hebben aptameren veel aandacht getrokken in een wijdverbreid onderzoeksgebied en komen ze naar voren als potentieel krachtige moleculen die in NDDS's kunnen worden gebruikt als het richtende ligand [23, 24]. Aptameren zijn op DNA of RNA gebaseerde oligonucleotidesequenties die secundaire en tertiaire structuren bezitten die affiniteit hebben met hun doelwitten, zoals celoppervlakreceptoren [23, 24]. Aptameren hebben ook verschillende voordelen ten opzichte van bijvoorbeeld, ze zijn niet-immunogeen en hebben een laag molecuulgewicht (8-25 kDa) met chemische en thermische stabiliteit. Bovendien is hun synthese en chemische modificaties goedkoop en schaalbaar [25]. De selectieve targeting van de NDDS's door middel van anti-EpCAM-specifiek aptameer zou kunnen worden beschouwd als een effectieve targetingoptie om chemotherapeutische middelen in de micro-omgeving van de tumor af te leveren [19, 26]. In dit opzicht hebben verschillende onderzoeken aangetoond dat met anti-EpCAM aptamer gefunctionaliseerde nanodragers de afgifte van geneesmiddelen tegen kanker aan tumorcellen effectief zouden kunnen verbeteren [15, 27, 28].
Het doel van deze studie is het ontwikkelen van een anti-EpCAM DNA-aptameer (SYL3C)-PEGylated-nanoliposomen geladen met doxorubicine (DOX) (ED-lip) als een model van NDDS. Een dergelijke functionalisering werd uitgevoerd door EDC/NHS-koppelingschemie tussen aminegroep van aptameer en carboxylgroep van DSPE-mPEG2000 , die achteraf in het liposoom wordt ingebracht zoals weergegeven in Fig. 1. De ED-lip wordt gekenmerkt door grootte, zeta-potentiaal en percentage doxorubicine-inkapseling, afgifteprofiel en cytotoxiciteit. Vervolgens evalueerden we of deze ED-lip de celopname in vitro zou kunnen verbeteren en DOX aan de tumor zou kunnen afleveren via targeting in muizen met C26 coloncarcinoomtumoren.
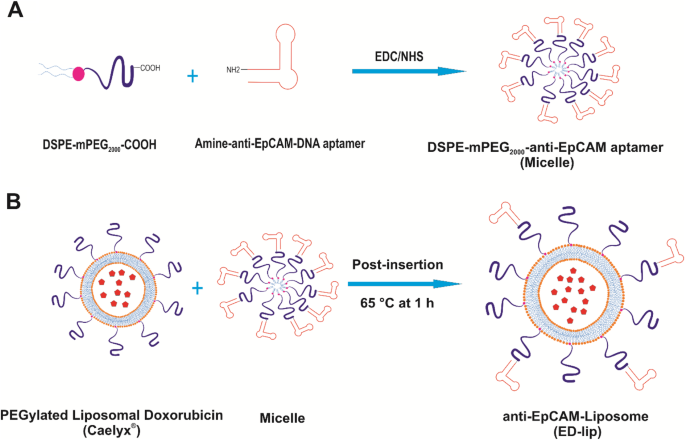
Bereiding van anti-EpCAM-gefunctionaliseerd Caelyx® (ED-lip). een Koppeling van anti-EpCAM-aptameer aan DSPE-mPEG2000 door covalente binding van de primaire aminen (-NH2) van anti-EpCAM-aptameer aan de carboxylgroep (-COOH) van DSPE-mPEG2000 . b Post-insertiemethode voor bereiding van anti-EpCAM-gefunctionaliseerde Caelyx® (ED-lip)
Resultaat en discussie
Caelyx®, gePEGyleerd liposomaal doxorubicine is een van de meest gebruikte chemotherapeutische middelen en is het eerste door de FDA goedgekeurde nanodeeltje dat is geïndiceerd voor de behandeling van eierstokkanker, AIDS-gerelateerd Kaposi-sarcoom en multipel myeloom. Caelyx® drong passief door tot de tumorplaats via het EPR-effect [29]. Hoewel Caelyx® de farmacokinetiek en de halfwaardetijd van DOX aanzienlijk heeft verbeterd; de belangrijkste beperkingen van Caelyx® zijn echter onvoldoende cellulaire opname en lage afgiftesnelheid van het geneesmiddel op de tumorplaats [29]. Hier gebruikten we SYL3C-aptameer als een targeting-ligand om liposomaal doxorubicine (ED-lip) te functionaliseren om het EpCAM-molecuul in het oppervlak van kankercellen te targeten, wat de levering van DOX aan een specifieke doelwitplaats mogelijk maakt via het proces van actieve targeting.
Vervoeging van DSPE-mPEG2000 naar Aptameer
In de huidige studie hebben we EDC/NHS-koppelingschemie gebruikt voor de conjugatie van met amine gefunctionaliseerde anti-EpCAM-aptameren aan de actieve carboxylgroep van DSPE-mPEG2000 -COOH. Het voordeel van deze koppelingsreactie met behulp van EDC/NHS-koppelingschemie en vorming van de amidebinding is de stabiliteit en het verminderen van niet-specifieke interacties tussen aptameren [30]. Aptameren kunnen worden gemodificeerd met een primaire amine- of thiolgroep en covalent worden geconjugeerd om respectievelijk de carboxyl- of pyrroolgroep van maleïmide te activeren [31]. Aptameren gemodificeerd met thiolgroep werden geconjugeerd aan de maleïmide functionele groep van DSPE-PEG2000 . Dan, DSPE-PEG2000 -aptameer achteraf ingebracht in de liposoomstructuur om het buitenoppervlak van liposomen te verfraaien [32]. Een belangrijke beperking van de maleïmide-thiolchemie is dat tijdens opslag de thiolgroep van aptameren kan worden beïnvloed door oxidatie, wat kan leiden tot de vorming van een disulfidebinding (S-S) tussen twee met thiol gemodificeerde aptameren. Deze dimere aptameren kunnen niet deelnemen aan de conjugatiereactie met de maleïmide functionele groep van DSPE-PEG2000 [30]. Daarom verhoogt het gebruik van EDC/NHS-reacties de productopbrengsten en verbetert de post-insertion-methode.
Aptameer heeft enkele voordelen ten opzichte van de antilichamen, waaronder gemakkelijke synthese en opschaling, lage systemische toxiciteit en gebrek aan immunogeniciteit [33]. Hier werd, na conjugatie van aptamer aan het lipide, de post-insertiemethode aangewend om Caelyx® (ED-lip) met anti-EpCAM met aptamer versierde te maken. Over het algemeen is de post-insertietechniek een eenvoudige en effectieve methode voor het hechten van aptameren aan het oppervlak van liposomen en zorgde voor een hogere snelheid van opname van aptameren in liposomen [34].
We gebruikten gelelektroforese mobiliteitsverschuivingstest voor evaluatie van post-insertie van anti-EpCAM-aptameer op liposoom. Zoals getoond in Fig. 2, migreerden de negatief geladen aptameren in de gel en hun band werd waargenomen terwijl er geen tegenhangerband is voor ED-lipformulering, omdat ED-lip gevangen zat in de putlijn en niet door de gel kon bewegen. Deze resultaten gaven aan dat met aptameren geconjugeerde micellen met succes achteraf in het oppervlak van liposomen werden ingebracht.
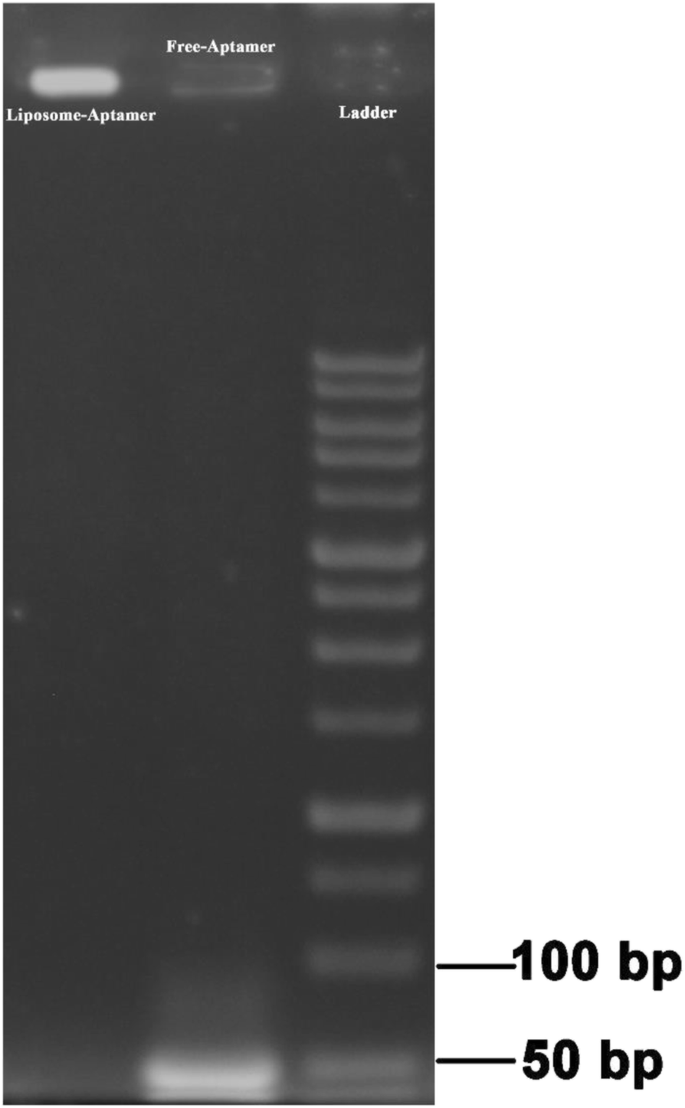
Agarosegel-elektroforese van ED-lipformulering. Monsters worden op de agarosegel geladen. UV-licht visualiseerde de gel. De putjes die overeenkomen met ladder, vrije aptameren en PL-geconjugeerde aptameren zijn aangegeven. Gebrek aan corresponderende band in liposoom-Aptameer gaf de bevestiging na het inbrengen aan
Fysisch-chemische karakterisering van ED-lip
De fysisch-chemische karakterisering van Caelyx® en ED-lip werd aangetoond in Tabel 1. De grootte en lading van bereide formuleringen onthulden dat modificatie van Caelyx® met anti-EpCAM aptamer geen significant effect had op de deeltjesgrootte (p> 0,05). Liposomale grootte vóór insertie van aptamer (Caelyx®) was ongeveer 96 nm met PDI van 0,11, na de post-insertie (ED-lip) nam de grootte van liposomen gedeeltelijk toe tot 117 nm met PDI van 0,14 die een gewenste grootte hebben voor levering aan tumor. De resultaten van eerdere onderzoeken gaven ook aan dat opname van targeting-liganden leidt tot toename in grootte en PDI van liposomen [35, 36]. Bovendien werd de zeta-potentiaal van de ED-lip (− 19,25) negatiever dan Caelyx® (− 12). Er werd aangetoond dat de RNA-aptameer-conjugatie in het liposoom resulteerde in de afname van het zeta-potentieel van het liposoom [37]. De toename in de grootte en het negatieve zeta-potentieel van de ED-lip zou een bewijs kunnen zijn van succesvolle post-insertie van geconjugeerde aptameren op het oppervlak van liposoom [38]. Deze resultaten zijn consistent met onze eerdere studie die aangaf dat aptameer aan het oppervlak van Caelyx® was gehecht, wat leidde tot een lichte toename van de deeltjesgrootte en de meer negatieve zeta-potentiaal in de met aptameer gefunctionaliseerde Caelyx® [38, 39]. De werkzaamheid van post-insertie moet echter worden getest in termen van incubatietijd en temperatuur om een efficiënter liposoom na het inbrengen te bereiken met een betere grootte en PDI. De inkapselingsefficiëntie van de Caelyx® en ED-lip was 100% (zie tabel 1).
Het aantal aptameren dat achteraf op het liposoomoppervlak werd ingebracht, werd bepaald zoals beschreven [6]. Het totale gehalte aan fosfolipiden van de liposomale formulering, bepaald door middel van een fosfaattest, was 14 mM. Aangezien het gemiddelde aantal lipidemoleculen in liposoom met een gemiddelde grootte van 100 nm 8× 10 4 is het aantal liposomen in elke milliliter is bijna 10 14 [38]. Het molecuulgewicht van aptameer was g/mol. Het aantal DSPE-mPEG2000 -aptameer werd bepaald op basis van fosfaatbepalingsmethoden waarbij molen fosfaatmoleculen overeenkomt met molen geconjugeerde moleculen. Op basis van deze gegevens is het aantal aptameermoleculen per aliquotsoplossing van elke ml 10 15 .
DOX-releaseprofiel
Het inbrengen van met aptameer geconjugeerde micellen in het buitenoppervlak van Caelyx® kan het afgifteprofiel van de DOX beïnvloeden. Daarom hebben we de afgifte van DOX-vorm ED-lip geëvalueerd in vergelijking met de Caelyx® in 5% dextrose met 50% FBS. Dit medium zou het afgiftegedrag van de formuleringen in het plasma kunnen nabootsen [40]. Figuur 3 toonde aan dat er geen significant verschil is in DOX-afgifte van Caelyx® en ED-lip-formuleringen gedurende 24 uur onderzoek en dat alleen de verwaarloosbare hoeveelheden DOX werden afgegeven. Dit komt overeen met onze eerdere onderzoeken die aangaven dat het inbrengen van aptameer op het oppervlak van liposoom geen invloed had op de membraanstabiliteit en het afgifteprofiel van DOX [38, 39]. Dit is voornamelijk te danken aan de stabiliteit van de Caelyx®-formulering die werd geformuleerd met behulp van een pH-gradiëntgestuurde methode voor laden op afstand [41].
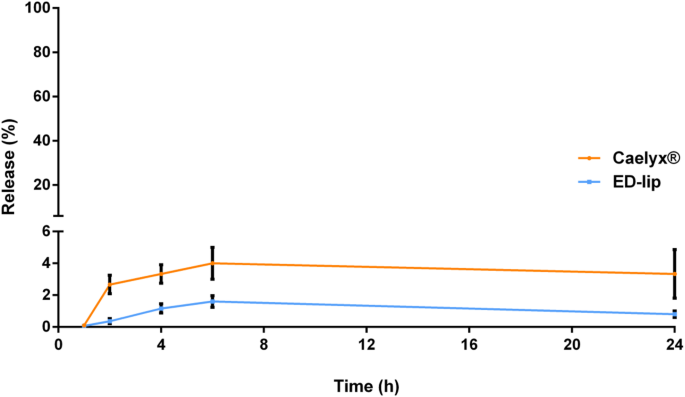
Studie vrijgeven. Lekkageprofiel van DOX-gehalte van Caelyx® en ED-lip bij 37 °C bij aanwezigheid van 50% FBS in dextrose gedurende 24 uur onderzoek. Gegevens weergegeven als gemiddelde ± standaarddeviatie (SEM) (n =3)
Celinteractie en celopname door fluorescentiemicroscopie
De celinteractie en celopname van liposomale formuleringen werden geëvalueerd bij 4 ° C en 37 ° C en is weergegeven in Fig. 4. De evaluatie van de doelgerichtheid van ED-lip gaf aan dat er geen verschillen waren tussen de gemiddelde fluorescentie-intensiteiten (MFI's) van CHO-K1-cellen behandeld met Caelyx® en ED-lip bij 4 ° C en 37 ° C (Fig. 4a, c). De gegevens toonden echter aan dat gerichte ED-lip aanzienlijk hogere opname door C26-cellen had in vergelijking met Caelyx® bij 4 ° en 37 ° C (Fig. 4b, d), wat statistisch significant was bij 37 ° C (p ik> <0,0001). De ED-lip had de significante opname in vergelijking met de Caelyx® (p <0,001). Deze resultaten gaven aan dat ED-lip verhoogde doelwitspecificiteit vanwege anti-EpCAM-aptameer een grotere affiniteit heeft voor C26-cellijn in vergelijking met CHO-K1-cellen. Vrij DOX wordt vrij door de lipide dubbellaag geleid en komt de cel binnen, dus heeft de hoogste celopname onder de formuleringen en heeft daarom de hoogste cytotoxiciteit. In het geval van Caelyx® beperkt PEGylatie de snelheid van endocytose en resulteerde in een verminderde cytotoxiciteit. De aanwezigheid van anti-EpCAM-aptameer op het oppervlak van liposoom (ED-lip) verhoogt echter de snelheid van internalisatie van de formulering in de cellen en verhoogt de cytotoxiciteit ervan in vergelijking met Caelyx® [38]. De gegevens van fluorescentiemicroscopie toonden aan dat het verschil tussen cellulaire opname van ED-lip en vrije DOX in C26-cellijn bij 37 ° C niet significant was (figuur 5). Schaalvorming op basis van de intensiteit van geïnternaliseerd DOX weergegeven in Tabel 2 waarin zowel ED-lip als DOX statistisch significante verschillen hebben laten zien met Caelyx® in C26 cellulaire opname (p <0,001). Hoewel C26-cellen een laag niveau van EpCAM op hun oppervlak tot expressie brengen [42], suggereerden de gegevens van deze studie dat de aanwezigheid van anti-EpCAM-aptameer de snelheid van internalisatie van liposomen zou kunnen verhogen [43].
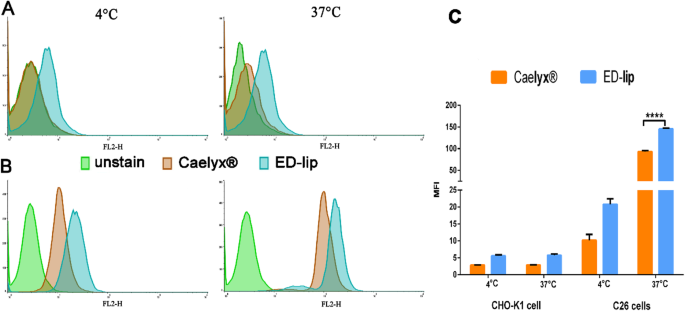
Celinteractie en celopname van liposomale formuleringen geëvalueerd bij 4 ° C en 37 ° C. een De CHO-K1-celinteractie van de formuleringen bij 4 ° C en 37 ° C. b De interactie van formuleringen met C26-cellen bij 4 ° C en 37 ° C. c De grafiek toonde gemiddelde MFI van formuleringen op CHO-K1- en C26-cellen. Gegevens weergegeven als gemiddelde ± standaarddeviatie (SEM) (n =3). ****p <0,0001
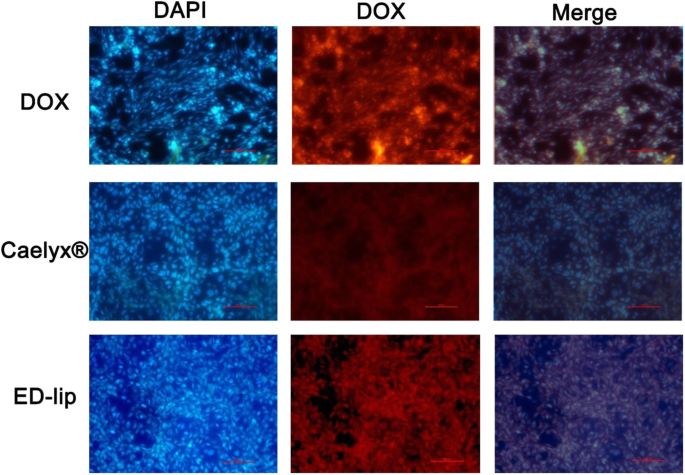
Fluorescerende microscopie. De resultaten van celinternalisatie van DOX op C26-cellijnen gevisualiseerd door fluorescentiemicroscopie. Cellen gekleurd met DAPI. Zowel vrije DOX als ED-lip hebben een hoger niveau van DOX-internalisatie in vergelijking met de Caelyx®. Cellen geïnspecteerd onder een vergroting van × 200
Cytotoxiciteitsonderzoek
De cytotoxiciteitseffecten van vrije DOX-, Caelyx®- en ED-lipformuleringen zijn aangegeven in Fig. 6. Verschillende concentraties van formuleringen die werden gebruikt om cellen gedurende 1, 3 en 6 uur te behandelen en gedurende de volgende 72 uur te incuberen. Gegevens toonden aan dat alle formuleringen effecten hebben op cellen in tijd en dosisafhankelijke wijze. De levensvatbaarheid van C26-cellen behandeld met ED-lip formulering nam af in vergelijking met met Caelyx® behandelde cellen. Aangezien CHO-K1-cellen, als EpCAM-negatieve cellen, een lagere respons op ED-lip vertonen in vergelijking met C26-cellen, lijkt het erop dat anti-EpCAM-aptameer de specifieke afgifte van Caelyx® aan doelcellen verhoogde. Deze resultaten zouden de specifieke cellulaire opname van ED-lip door C26-cellen kunnen bevestigen. Deze resultaten benadrukten het belang van het gebruik van gerichte medicijnafgifte met specifieke targetingmiddelen voor selectieve afgifte van medicijn aan doelcellen met vermindering van de bijwerkingen van medicijn door off-target te vermijden [44]. Zoals eerder gemeld, leidde de actieve targeting van Caelyx® met specifieke targeting-liganden zoals aptamer en antilichaam tot een verhoogde actieve tumortargeting en specifieke medicijnafgifte aan doelwitcellen, wat op zijn beurt de therapeutische werkzaamheid van DOX verhoogde [35, 39].
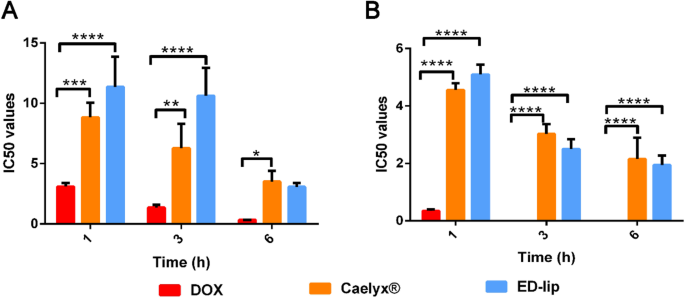
In vitro cytotoxiciteitseffect (IC50) van ED-lip, Caelyx® en vrij doxorubicine tegen CHO-cellen en C26-cellen na verschillende blootstellingstijden. Gegevens weergegeven als g/ml ± standaarddeviatie (SEM) (n =3). *p <0,05, **p <0,01, ***p <0.001, ****p <0,0001
Biodistributie en farmacokinetiek
Om te evalueren hoe anti-EpCAM-aptameer de biodistributie van DOX beïnvloedt, injecteerden we een dosis van 10 mg/kg ED-lip en Caelyx® in muizen met subcutane C26-darmkankertumoren. De DOX-concentratie in plasma op 3, 12, 24, 48 en 72 uur na injectie met Caelyx® en ED-lip is weergegeven in Fig. 7. De resultaten laten zien dat het gedrag van plasma-DOX-concentraties in beide groepen vergelijkbaar was en dat er was er geen significant verschil tussen beide formuleringen. Zoals weergegeven in Tabel 3, verminderde de conjugatie van anti-EpCAM-aptameer aan het liposomale oppervlak de circulatiehalfwaardetijd enigszins van 39,3 uur tot 34,2 uur en de MRT van 47,6 tot 42,9 uur (zie Tabel 3). De farmacokinetische parameters gaven aan dat de conjugatie van anti-EpCAM-aptameer op het liposoom licht verminderde t½ en MRT die consistent waren met eerdere rapporten, toonden aan dat conjugatie van aptameer op het liposomale oppervlak de klaring van liposomen versnelt [38]. Eiwitadsorptie en daaruit voortvloeiende verwijdering door mononucleair fagocytisch systeem (MPS) zou de reden kunnen zijn van de versnelling in bloedklaring van ligand-geconjugeerde nanodeeltjes [45].
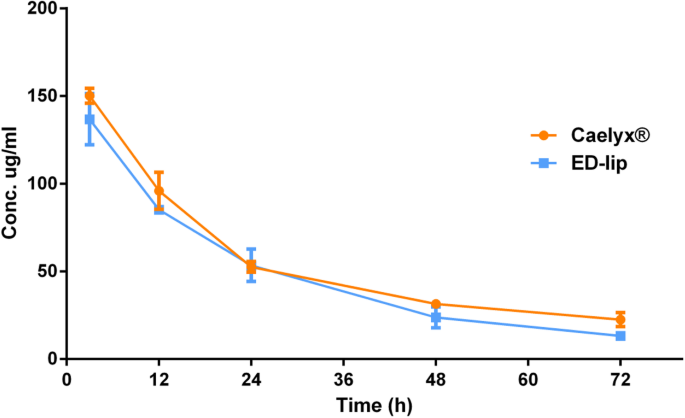
Plasmaniveau van DOX. De resultaten van de concentratie tegen de tijd van de hoeveelheid DOX in het bloed op 3, 12, 24, 48 en 72 uur na injectie. Gegevens weergegeven als gemiddelde ± standaarddeviatie (SEM) (n =3)
Zoals getoond in Fig. 8, werden de concentraties van DOX vergeleken in de belangrijkste geoogste organen in groepen die Caelyx® en ED-lip kregen. De belangrijkste bijwerking van vrij DOX is de cardiotoxiciteit waardoor Caelyx® de kans op deze bijwerking significant vermindert [46]. De biodistributie van ED-lip in de lever, longen en milt is significant hoger dan Caelyx® op tijdstip 3 uur. De aanwezigheid van lekkende bloedvaten en toename van de grootte en PDI van de ED-lip na post-insertie kunnen de redenen zijn voor meer accumulatie van ED-lip in deze weefsels in vroegere tijden. Er werd aangetoond dat de toename van de grootte van nanodeeltjes tot 150 nm de accumulatie van nanodeeltjes in de lever, longen en milt verbetert [47]. Ondertussen tonen de resultaten van biodistributiestudie duidelijk het EPR-mechanisme in de accumulatie van nanodeeltjes in de tumor. Figuur 8 laat duidelijk zien dat zowel ED-lip als Caelyx® zich geleidelijk ophopen in de tumorplaats en een maximum bereiken rond 12 uur, een plateau blijven tot 24 uur en daarna geleidelijk afnemen na 48 en 72 uur. Het is interessant op alle tijdstippen van 3, 12, 24, 48 en 72 uur; de accumulatie van ED-lip in tumor is aanzienlijk meer dan die van Caelyx®, wat te wijten zou kunnen zijn aan de werkzaamheid van de actieve targeting met anti-EpCAM-aptameer. Deze resultaten gaven aan dat de hechting van aptameer op de dosis van het liposoomoppervlak de DOX-verdeling in de nieren niet beïnvloedde. Daarom lijkt het erop dat anti-EpCAM-aptameren effectief tumorspecifieke penetratie van liposomen bevorderen, wat ook te wijten kan zijn aan de overexpressie van EpCAM-moleculen in vasculaire endotheelcellen van tumoren [48]. Eerder werd aangegeven dat anti-EpCAM-aptameren de tumorpenetratie in xenotransplantaattumoren zouden kunnen verbeteren [49]. De CSC's of TIC's zijn ook het doelwit van anti-EpCAM-therapie. De toediening van anti-EpCAM aptameren als targeting ligand om EpCAM te targeten liet veelbelovende effecten zien bij het targeten van CSC's [22, 50]. Hier zou kunnen worden gesuggereerd dat een deel van het efficiënte antitumoreffect van ED-lip te wijten zou kunnen zijn aan succesvolle targeting van CSC's.
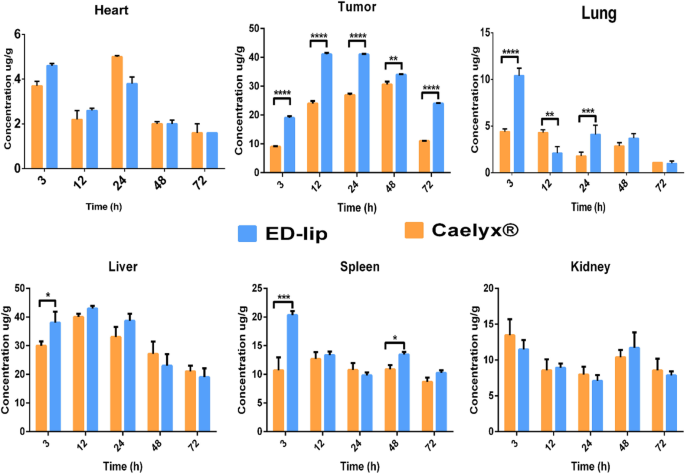
Weefsel biodistributie. De resultaten van DOX-biodistributie in hart, tumor, lever, longmilt en nier. De concentraties (μg/g) gerapporteerd op 3, 12, 24, 48 en 72 uur na injectie voor elk orgaan. Gegevens weergegeven als gemiddelde ± standaarddeviatie (SEM) (n =3). *p <0,05, **p <0,01, ***p <0.001, ****p <0,0001
In vivo antitumoractiviteit
Therapeutische werkzaamheid van ED-lip werd geëvalueerd in C26 coloncarcinoom tumormodel. Tumorgrootte, lichaamsgewicht en overleving werden gedurende bijna 2 maanden gevolgd en de resultaten zijn samengevat in Fig. 9 en Tabel 4. Gegevens geven aan dat ED-lip geen duidelijke invloed heeft op het lichaamsgewicht van muizen en op Caelyx® (zie Fig. 9a). ). Zoals getoond in Fig. 9b, wordt na intraveneuze injectie van Caelyx® en ED-lip de tumorgroeisnelheid efficiënt geremd tot dag 30 na injectie, en er is geen significant verschil in liposomale groepen. Na 30 dagen na de injectie versnelde de tumorgroei, maar de groeisnelheid in de groepen die geneesmiddelen ontvingen was nog steeds langzamer dan in de groep die de PBS ontving. Het verschil tussen de Caelyx®-groep en ED-lip was niet significant gedurende 30 dagen na injectie. De overlevingsresultaten worden weergegeven in een Kaplan-Meier-plot. Figuur 9c laat zien dat ED-lip de overlevingscurve verbetert in vergelijking met PBS of Caelyx®. De belangrijkste indicatoren van het overlevingsonderzoek zijn samengevat in Tabel 4. De tumoren in drie muizen van de ED-lip-groep waren volledig genezen, dus de MST voor deze groep is niet gedefinieerd. Behandeling met ED-lip verhoogde TTE van 41,1 naar 49,7 dagen en resulteerde in effectieve antitumoractiviteit met 90,27% TGD met ongedefinieerde MST als gevolg van volledige verwijdering van de tumor bij drie muizen (zie tabel 4).
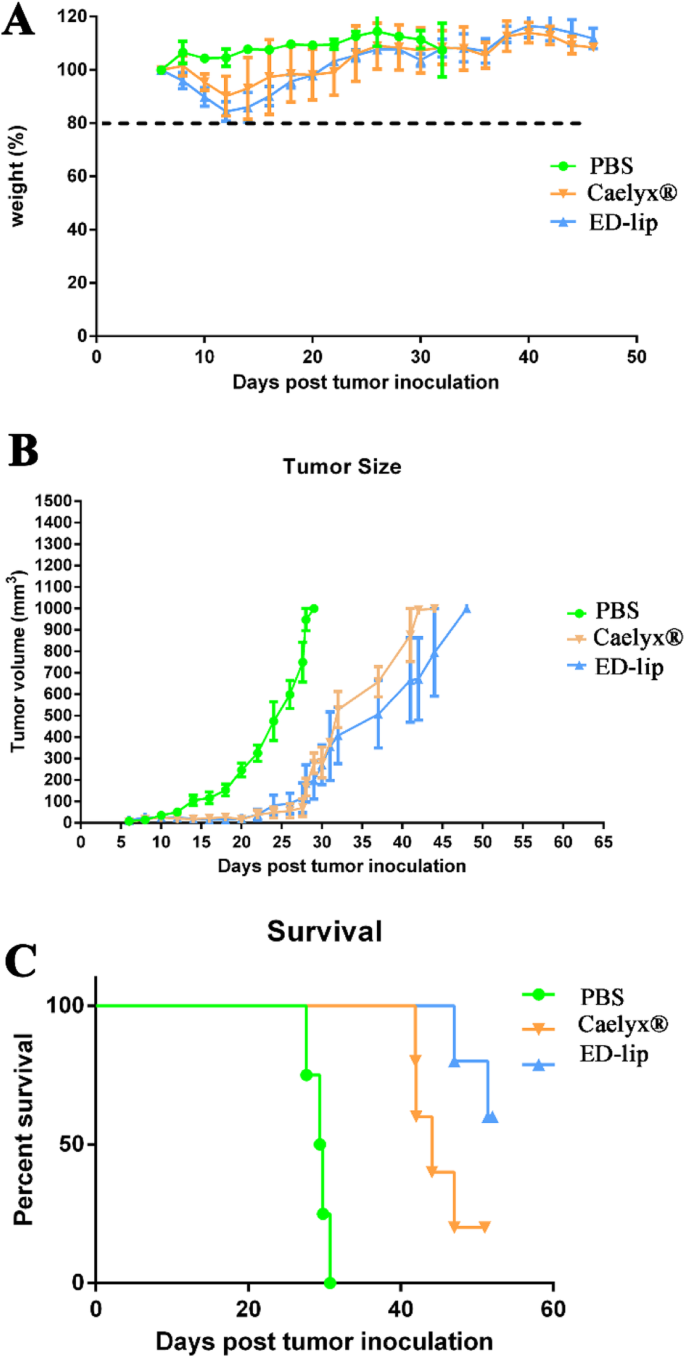
In vivo therapeutische werkzaamheid van formuleringen bij vrouwelijke BALB/c-muizen die C26-coloncarcinoom dragen. Muizen kregen IV injectie van een enkele dosis formuleringen (10 mg/kg). een Vertegenwoordigt het respectieve gewichtspercentageprofiel van de BALB/c in elke experimentele groep. b Toont de follow-ups van de tumorgrootte in BALB/c-muizen. c Toont de overlevingsgrafiek voor BALB/c. Gegevens weergegeven als gemiddelde ± SD (n =5)
Tumorgroottegegevens toonden aan dat ED-lip de tumorgroei dramatisch kon remmen. De resultaten van de overlevingsanalyse toonden aan dat behandeling met ED-lip MST en TTE verhoogde. De groep die ED-lip kreeg, had een hoger TGD% en was effectiever in vergelijking met Caelyx®. Onze bevindingen komen overeen met het hoge niveau van DOX-concentratie in het tumorweefsel van de met ED-lip behandelde groep. Daarom verbetert met aptamer geconjugeerd liposomaal DOX hun penetratie en bijgevolg de accumulatie van het geneesmiddel in de tumorplaats, wat op zijn beurt leidt tot een toename van de werkzaamheid van Caelyx® en een hoger TGD% in overlevingsgegevens. Alles bij elkaar genomen geven deze bevindingen aan dat anti-EpCAM-aptameren zouden kunnen dienen als een belangrijk doelwit voor medicijnafgifte.
Conclusie
Hier hebben we Caelyx® met oppervlaktefunctionaliteit met anti-EpCAM (SYLC3) aptamer via post-insertion (ED-lip). De flowcytometrie en fluorescentiemicroscopie toonden een hoog niveau van DOX-opname in C26-cellen, wat aangaf dat aptamer de snelheid van internalisatie van ED-lip zou kunnen verbeteren. De farmacokinetische gegevens gaven aan dat de post-insertie van DSPE-mPEG-EpCAM de farmacokinetiek van DOX niet veranderde in vergelijking met Caelyx®. De biodistributie van weefsel toonde echter aan dat er meer tumoraccumulatie van ED-lip was in vergelijking met Caelyx®, zelfs na 72 uur na injectie. We hebben aangetoond dat ED-lip verbeterde therapeutische effecten had bij muizen met C26-tumoren. De verbeterde overlevingsparameters bij muizen die met ED-lip zijn behandeld, suggereren dat het op EpCAM gerichte DOX-liposoom een veelbelovende drager is van medicijnafgifte voor de behandeling van kankers en nader onderzoek verdient.
Materialen en methoden
Materialen
Het 5'-Amine-anti-EpCAM DNA-aptameer (sequentie van 5'-CACTACAGAGGTTGCGTCTGTCCCACGTTGTCATGGGGGGTTGGCCTG-3') (SYL3C) werd gekocht bij BIONEER (biotechnologiebedrijf, Daejeon, Zuid-Korea). DSPE-mPEG2000 -COOH werd gekocht van Avanti Polar Lipids (Alabaster, AL). Dowex®, 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide (EDC), N-Hydroxysuccinimide (NHS), penicilline streptomycine en FluoroshieldTM met DAPI werden gekocht bij Sigma-Aldrich (St. Louis, MO). In de handel verkrijgbare caelyx® werd gekocht bij Behestan Darou Company (Teheran, Iran).
Vervoeging van DSPE-mPEG2000 naar Aptameer
Anti-EpCAM-aptameer was gekoppeld aan DSPE-mPEG2000 door covalente binding van de primaire aminen (-NH2) van anti-EpCAM-aptameer aan de carboxylgroep (–COOH) van DSPE-mPEG2000 (Figuur 1). Conjugatie werd uitgevoerd via EDC/NHS-koppelingschemie [51]. In het kort, DSPE-mPEG2000 werd gedispergeerd in 2-(N-morfolino)ethaansulfonzuur (MES)-buffer (pH 6,5) en EDC/NHS 400 mM EDC en 100 mM NHS werden aan de dispersie toegevoegd. De dispersie liet 15 min roeren toe om carboxylgroepen van lipide te activeren. Vervolgens werd anti-EpCAM-aptameer aan de dispersie toegevoegd en gedurende de volgende 2 uur in het donker bij kamertemperatuur geroerd. De molverhouding van lipide:anti-EpCAM-aptameer was 1:1 en de molverhouding van EDC/NHS was 10 keer die van lipide.
Wijziging van Caelyx® met DSPE-mPEG-Anti-EpCAM Aptamer
ED-lip werd gesynthetiseerd door de post-insertion-methode. Om post-insertie uit te voeren, werden DSPE-mPEG-anti-EpCAM aptamere micellen toegevoegd aan 1 ml caelyx® gedurende 30 minuten bij 60°C. De hoeveelheden DSPE-mPEG-EpCAM-aptameer werden bepaald volgens Bartlett-fosfaatassay [52]. Gebaseerd op het geschatte aantal liposoom per milliliter van caelyx®, dat is ongeveer 10 14 , werd het volume DSPE-mPEG-anti-EpCAM aangepast om 10 aptamer per liposoom te bereiken [36]. Agarosegelelektroforese gebruikt om post-insertie te bevestigen [39].
Fysisch-chemische karakterisering
Deeltjesgrootte, polydispersiteitsindex (PDI) en oppervlaktelading werden bepaald door Dynamic Light Scattering instrument (DLS) (Nano-ZS; Malvern, VK). Om vrij DOX te verwijderen, werden liposomen gemengd met Dowex®-hars en 60 min geroteerd en door Poly-Prep-kolommen (Bio-Rad Laboratories Inc.) geleid om de Dowex® [53] te verwijderen. De hoeveelheden DOX in liposomale formuleringen werden bepaald met behulp van LS-45 fluorescentiespectrofotometer (Perkin-Elmer, VK), (excitatie:emissie 485:590 nm).
Releaseonderzoek
Om de afgifte van DOX te beoordelen, werd 1 ml formulering toegevoegd aan de 9 ml dextrose (met 50% foetaal runderserum (FBS)) en met bepaalde tijdsintervallen (0, 1, 2, 4, 6, 12 en 24 uur), werden monsters genomen. Na verwijdering van vrij DOX met Dowex®-hars werden de hoeveelheden geneesmiddel die in de liposomen achterbleven bepaald met een fluorescentiespectrofotometer en werd het afgiftepercentage berekend [39].
Celcultuur
C26 coloncarcinoom en Chinese hamster ovarium (CHO-K1) cellijnen werden gekocht bij het Pasteur Institute of Iran. Cellijnen werden gekweekt in RPMI1640-medium aangevuld met 10% FBS verkregen van Gibco (Thermos Fisher Scientific, VS) en 100 IU/ml penicilline en 100 mg/ml streptomycine. De cellen werden geïncubeerd bij 37 ° C met een CO van 5%2 en 95% luchtbevochtigde atmosfeer.
Celinteractie en cellulaire opnametest
Celinteractie en celopname van formuleringen werden geëvalueerd bij respectievelijk 4 ° C en 37 ° C. Bij deze test werden twee cellijnen, CHO-K1 en C26, geselecteerd. De cellen werden uitgezaaid in elk putje van platen met 12 putjes (2,5 × 10 5 per well). After overnight incubation in 37 °C, treatments added to the cells and plates were placed at 4 °C and 37 °C and incubate for another 3 h. Then cells washed with PBS, and trypsinized. The fluorescence intensity for DOX was determined using flow cytometry (BD FACSCalibur cytometer). The data were analyzed with FlowJo version 7.0 software.
Fluorescent Microscopy Evaluation
The number of 1 × 10 6 cells per well C26 Cells were seeded into 6-well plates in which sterile microscopic cover glass were already inserted. After overnight incubation in 37 °C and 5% humidity, cells were treated with free DOX, Caelyx® and ED-lip for 24 h for complete cell uptake [54]. Then cells washed with PBS and fixed with 4% formaldehyde. Cover glasses stained with Fluoroshield™ with DAPI and were mounted on the glass slides. Treatments were performed in triplicate. From each slide, six zones were selected under × 200 magnification field. Intrinsic fluorescent of DOX was used for evaluation of drug cell uptake. Scaling was performed based on the percentages of cells which shown DOX cell uptake in each microscopic filed:
1:0–20%, 2:20–40%, 3:40–60%, 4:60–80%, and 5:80–100%
Evaluation of Cytotoxicity
The IC50 values of free DOX, caelyx®, and ED-lip were determined by MTT assay. In order to do this, CHO-K1 and C26 cells were seeded at density of 5 × 10 3 cells per well in 96-well plates at 37 °C. After overnight incubation liposomal formulations and free DOX solution were serially diluted in FBS-free medium and added to cell cultures and incubated 1, 3, and 6 h at 37 °C. Then, cells were washed and allowed to incubate 72 h. The optical densities (ODs) were measured using a spectrometric absorbance of 570 nm against a background of 630 nm on Stat-Fax 2100 microplate reader (Awareness Technology Inc. USA). Then the IC50 values were calculated.
Animal Study
Female BALB/c mice (4–6 weeks, 18–20 g) were kept in separate cages at 22 ± 2 °C and maintained on standard pellet diet and water ad libitum. Intraperitoneal (i.p) injection of ketamine and xylazine (100 mg/kg ketamine and 10 mg/kg xylazine) used to anesthetize the animals [55]. The number of 3 × 10 5 C26 cells per mouse in 60 μl PBS injected at the right flank, subcutaneously. Two weeks after inoculation when tumor sizes grew about 5 mm 3 , mice were randomly divided into 3 groups (n =3 for biodistribution and n =5 for antitumor study mice per group). All of the experimental protocols were approved by the Mashhad University of Medical Sciences committee for animal ethics and were performed according to the international rules considering the animal rights.
Biodistribution and Pharmacokinetic Studies
Fourteen days after tumor inoculation, mice were treated with dose of 10 mg/kg of caelyx® and ED-lip intravenously (i.v.) via the tail vain. Control group received 200 μl PBS solution. At certain time-intervals (3, 12, 24, 48, and 72 h) post-injection mice were euthanized and blood samples and tissue samples (liver, spleen, kidney, lung, heart, and tumor) were collected. Then, the concentration of doxorubicin in each sample measured based on fluorescent intensity of each samples using LS-45 fluorescence spectrophotometer (Perkin-Elmer, UK). Doxorubicin concentration of each sample was measured and non-compartmental analysis of the pharmacokinetic parameters were calculated from blood concentration vs. time profiles. Then the parameters including under the concentration-time curve (AUC) and area under the first moment curve (AUMC), half-life (t 1/2 ), volume of distribution (V d ), C max , T max,, mean residence time (MRT), and clearance (Cl) were calculated.
In Vivo Antitumor Activity
In order to evaluate antitumor activity, 10 days after tumor inoculation, mice with palpable tumor size were received single i.v. dose of 10 mg/kg Caelyx® and ED-lip. PBS injected in mice which considered as negative control. The parameters including time to reach the endpoint (TTE), percentage of tumor growth delay (TGD), median survival time (MST), and survival were determined. During the study, mice were observed for health and body weight changes. The tumor volume was also measured using a digital caliper and calculated as follows:
$$ \mathrm{Tumor}\ \mathrm{Volume}=\left(\mathrm{Height}\times \mathrm{Length}\times \mathrm{Width}\right)\times 0.52 $$Considering ethical aspects, mice were removed in case tumor growth was> 1000 mm 3 , or> 20% weight loss or sign of weakness was observed.
Statistical Analysis
Data were analyzed using GraphPad Prism 6.0 (GraphPad software, Inc., San Diego, CA, USA). Data were demonstrated as mean ± SEM of at least three independent experiments. The t test was used in order to evaluate the results of release study, flow cytometry, and biodistribution of the formulations. ANOVA was employed to evaluate the results of fluorescent microcopy and tumor volumes. The Kaplan–Meier method used to calculate the survival parameters include TTE, MST and TGD%. P <0.05 was considered statistically significant.
Beschikbaarheid van gegevens en materialen
Alle gegevens die de conclusies van dit artikel ondersteunen, zijn in het artikel opgenomen.
Afkortingen
- EpCAM:
-
Epithelial cell adhesion molecule
- NDDSs:
-
Nano drug delivery systems
- DOX:
-
Doxorubicin
- EPR:
-
Enhanced permeability and retention
- ECM:
-
Extra cellular matrix
- CSC:
-
Cancer stem cell
- TIC:
-
Tumor initiating cell
- MFI:
-
Mean fluorescent intensities
- MPS:
-
Mononuclear phagocytic system
- EDC:
-
1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide
- NHS:
-
N-hydroxysuccinimide
- PDI:
-
Polydispersiteitsindex
- DLS:
-
Dynamic light scattering instrument
- FBS:
-
Foetaal runderserum
- OD:
-
Optische dichtheid
- AUC:
-
Area under the concentration-time curve
- AUMC:
-
Area under the first moment curve
- t ½ :
-
Half-life
- V d :
-
Volume of distribution
- MRT:
-
Mean residence time
- Cl:
-
Clearance
- TTE:
-
Time to reach the endpoint
- TGD:
-
Percentage of tumor growth delay
- MST:
-
Median survival time
- i.p.:
-
Intraperitoneally
- i.v.:
-
Intravenously
Nanomaterialen
- Nanovezels en filamenten voor verbeterde medicijnafgifte
- Omgevingsgevoelige metaal-organische raamwerken als medicijnafgiftesysteem voor tumortherapie
- Nanodeeltjesafgifte van artesunaat verbetert de antitumorefficiëntie door mitochondria-gemedieerde celapoptose te activeren
- 131I-getraceerde PLGA-lipide nanodeeltjes als dragers van medicijnafgifte voor de gerichte chemotherapiebehandeling van melanoom
- Met resveratrol geladen albumine-nanodeeltjes met verlengde bloedcirculatie en verbeterde biocompatibiliteit voor zeer effectieve gerichte pancreastumortherapie
- In vitro onderzoek naar de invloed van Au-nanodeeltjes op HT29- en SPEV-cellijnen
- Nieuwe biocompatibele Au Nanostars@PEG-nanodeeltjes voor in vivo CT-beeldvorming en eigenschappen voor nierklaring
- Bioveiligheid en antibacterieel vermogen van grafeen en grafeenoxide in vitro en in vivo
- Synthese en in vitro prestaties van met polypyrrool gecoate ijzer-platina nanodeeltjes voor fotothermische therapie en foto-akoestische beeldvorming
- 5-aminolevulinezuur-squaleen nanoassemblages voor tumorfotodetectie en therapie:in vitro studies
- Nieuwe Anodic Catalyst Support voor Direct Methanol Fuel Cell:Karakteriseringen en Single-Cell Performances



