Een vergelijkend in vivo onderzoek van gebiosynthetiseerde koper- en zinkoxide-nanodeeltjes via intraperitoneale en intraveneuze toedieningsroutes bij ratten
Abstract
Momenteel worden antimicrobiële eigenschappen van koper (Cu) en zinkoxide (ZnO) nanodeeltjes (NP's) uitgebreid gebruikt om de groei van pathogene microben te bestrijden. CuNP's en ZnONP's worden herhaaldelijk gebruikt in cosmetica, medicijnen en voedseladditieven, en hun potentieel voor toxische effecten op mens en ecosysteem is zeer zorgwekkend. In deze studie werd het lot en de toxiciteit van gebiosynthetiseerd koper (Bio-CuNP's) en zinkoxide (Bio-ZnONP's) met een bereik van 16 tot 96 nm beoordeeld bij mannelijke Wistar-ratten. In vivo blootstellingen van de twee nanodeeltjes worden bereikt via twee verschillende toedieningsroutes, namelijk intraperitoneale (i/p) en intraveneuze (i/v) injecties. De drie verschillende concentraties, concentratie zonder waarneembare nadelige effecten (NOAEC), remmende concentratie (IC50 ) en totale letale concentratie (TLC), werden geschat op het dosisbereik van 6,1 tot 19,82 g/kg en 11,14 tot 30,3 μg/kg voor respectievelijk Bio-CuNP's en Bio-ZnONP's, voor zowel i/p- als i/v-routes op 14e en 28e observatiedag. Deze dosisbereiken worden overwogen op basis van de eerdere studie van antibacteriële doses op multiresistente pathogene bacteriën. In deze studie hebben we het toxische effect van Bio-CuNP's en Bio-ZnONP's op diergedrag, diermassa, hematologische indices, orgaanindices en histopathologie van lever-, milt-, nier- en hersenorganen onderzocht. We ontdekten dat i/v- en i/p-toediening van Bio-ZnONP's in drie verschillende doses geen mortaliteit veroorzaakte en dat het lichaamsgewicht tot de tweede week van toediening enigszins was verminderd in vergelijking met de vehiculumcontrolegroep. Bij de dosisbereiken van 11–16 g/kg (i/v) en 24–30 μg/kg (i/p) werden geen significante veranderingen waargenomen in het serumcreatininegehalte, evenals in serum-ALAT, serum-AST-gehalte en ALP niveau die 40,7 mg/dl, 37,9 IE/l en 82,4 IE/l normaal waren in vergelijking met vehiculumcontrole op de 14e en 28e dag van observatie. Deze bevindingen worden bevestigd in lever-, nier- en miltindexen en histopathologische onderzoeken. Bovendien trad lever- en nierbeschadiging op wanneer de concentraties van Bio-CuNP's 9,5 μg/kg waren (IC50 ) en 11,7 μg/kg (TLC) voor i/v toedieningsweg. Evenzo werd ook een toename van serum-ALAT (67,7 mg/dl), AST-spiegel (70 IE/l) en ALP (128 IE/l) waargenomen. En het lichaamsgewicht was significant lager dan in de controlegroep na de 14e dag, en er werden statistisch significante verschillen waargenomen via deze route; interessant genoeg is de toxiciteit van Bio-CuNP's in serum verlengd (tot de 28e dag). Het effect van Bio-CuNP's via de i/p-route was aanzienlijk laag in vergelijking met de controle. Resultaten van de huidige studie toonden aan dat Bio-ZnONP's geen effect hebben op biomarkers voor nier- en leverfunctie (zowel i/v als i/p) in vergelijking met Bio-CuNP's.
Zoals te zien is in de grafische samenvatting (Fig. 1), is ons doel om de toxiciteit van Bio-CuNP's en Bio-ZnONP's te beoordelen door middel van een in vivo protocol. Volgens beoordelingen van Kahru en Dubourguier zijn AgNP's, CuNP's en ZnONP's van oudsher gebruikt als biociden om de groei van micro-organismen en algen te voorkomen (Kahru en Dubourguier 2010). Daarom moeten nanomaterialen, net als pesticiden, worden gecontroleerd op hun toxische reactie op niet-doelsoorten, waaronder mensen en dieren. Om beter te begrijpen of het per ongeluk vrijkomen van metaalhoudende NP's een bedreiging kan vormen voor niet-doelsoorten, is beoordeling van het toxische effect onontbeerlijk. Het 'niet-doelwitorganisme' is een organisme dat wordt blootgesteld aan NP's na hun incidentele vrijkomen in het milieu.
Achtergrond
Bepaalde metalen zijn nodig voor de normale fysiologische functies in levende organismen. Sinds het afgelopen decennium is het gebruik van op metaal gebaseerde NP's in biomedische toepassingen toegenomen, exponentieel gebruik van NP's waarschuwt de veiligheidsrisico's om door NP veroorzaakte nadelige effecten op het levende systeem te verminderen en/of te voorkomen [1]. Onder NP's worden Cu en ZnO over het algemeen gevonden in de voedingssupplementen en het menselijk lichaam [2, 3]. Unieke fysiochemische eigenschappen van Cu en ZnONP's bereiken functionele toepassingen in fysiologische metabolische processen, waardoor hun commerciële waarde in industrieën toeneemt [4,5,6]. Er werden echter nadelige effecten waargenomen, waaronder hemolyse, gastro-intestinale klachten en lever- en nierbeschadigingen bij overmatige inname van Cu en ZnONP's [7].
Met name de absorptie van CuNP's vindt gemakkelijk plaats na de inname, inademing en de dermale blootstelling [8, 9], aanzienlijk via het maagdarmkanaal [8, 10]. CuNP's richten zich op mucosale cellen en blijven binnen door binding met metallothioneïne of glutathion [11]. Het wordt voornamelijk opgeslagen in de lever, hersenen, hart, nieren en spieren. Er werd gemeld dat 98% van Cu bindt aan Ceruloplasmine, een serumeiwit dat leidt tot cellulaire toxiciteit. [12, 13].Cu is een katalytische inductor van superoxideradicalen, hydroxylradicalen en waterstofperoxide via de Haber-Weiss-reactie [14], hogere concentraties Cu kunnen oxidatieve stress veroorzaken.
Op basis van de mate van oplosbaarheid werden ZnONP's beschouwd als een afzonderlijke groep NP's binnen de metaaloxide-NP's [15]. Het zinkelement wordt aangetroffen in het menselijk lichaam en het is bekend dat ZnONP's minder toxisch zijn [3]. Er is echter gemeld dat overmatig zink toxische effecten veroorzaakt [16]. Vrijgave van metaalkationen Zn 2 van ZnONP's zijn ook toxisch gebleken bij micro-organismen en knaagdieren [17]. ZnO NP's kunnen via verschillende routes binnenkomen om de bloedstroom te bereiken en nadelige effecten op organen te veroorzaken [18]. Voorlopige resultaten gaven aan dat door ZnONP's aangetaste orgaansystemen ontstekingen, veranderde hartslag en functies en oxidatieve stress kunnen vertonen [19, 20]. Volgens [21] resulteerde inademing van 20 nm ZnONP's (2,5 mg/kg lg) door ratten tweemaal per dag in een verhoogd Zn-gehalte in de lever na 12 uur en in de nieren na 36 uur.
Verhoogd bewustzijn van nanotoxiciteit, er zijn onderzoeken gerapporteerd naar de in vivo toxiciteit van CuNP's en ZnONP's voor intranasale instillatie [22, 23], intratracheale instillatie [24, 25] en orale toediening [26,27,28], dermale blootstelling [29, 30]. Om de toxiciteit te evalueren moet intraveneuze (i/v) en intraperitoneale (i/p) toediening worden uitgevoerd. Voor zover wij weten, zijn er minimale rapporten beschikbaar over de toxiciteit van CuNP's en ZnONP's voor intraveneuze en intraperitoneale toediening. Bovendien zijn het toxicologische mechanisme en de weefseldistributie van de twee NP's nog niet systematisch bestudeerd na i/v- en i/p-injectie.
Hierbij hebben we de toxiciteit aangetoond van 16-96 nm ranged biosyntheized CuNP's en ZnONP's bij mannelijke wistarratten door middel van intraperitoneale (i/p) en intraveneuze (i/v) injecties op de gewenste 14e en 28e dag van observatie.
Methode
Biosynthese van bio-CuNP's en bio-ZnONP's
Biologische synthese van CuNP's en ZnONP's uit niet-pathogene Enterococcus faecalis werd aangepast door extracellulaire enzymatische methode [31, 32]. Verder werden de vorm en grootte van gesynthetiseerde nanodeeltjes bevestigd met behulp van veldemissie scanning elektronenmicroscopie (FeSEM) en transmissie-elektronenmicroscopie (TEM).
In-vivo-onderzoeken
Experimentele dieren en veeteelt
Specifieke ziektevrije mannelijke Wistar-ratten van 12 tot 13 weken oud werden gekocht bij Mahaveera Enterprises, Hyderabad, India. Dieren werden geselecteerd binnen een gewichtsbereik van 160-200 g voor elke groep en geacclimatiseerd gedurende 1 week voorafgaand aan de start van de behandeling, en de gezondheidsstatus van ratten werd dagelijks gecontroleerd. De dieren werden gehuisvest onder standaardomstandigheden van respectievelijk temperatuur (24 ± -1 ° C) en relatieve vochtigheid (55 ± -10 %), in cycli van 12 uur licht / donker. Tijdens de behandeling werden de dieren gehuisvest in kooien met roestvrijstalen gaasdeksels. Dieren werden gevoerd met in de handel verkrijgbaar standaard pelletdieet (VRK Nutrition Solutions, Sangli, Maharashtra, India Ltd.). Drinkwater werd ad libitum aan de dieren geleverd.
Toxiciteitsstudies werden uitgevoerd aan het Luqman College of Pharmacy, Kalaburagi, India. Het hanteren van dieren werd uitgevoerd volgens Good Laboratory Practice. Het onderzoeksprotocol is goedgekeurd door de Institute Animals Ethics Committee (goedkeuringsnummer:346/CPCSEA).
Bereiding en toediening van Bio-Cu en ZnONP's
De voorraadsuspensies van Bio-CuNP's en Bio-ZnONP's (50 mg / ml) werden bereid door een nacht afzonderlijk in dubbel gedestilleerd water op te lossen en werden gefiltreerd met behulp van 0,22 A-spuitfilters. Filtraten worden gebruikt om de werkstandaard te bereiden, variërend van 1,25-175 μg/ml concentratie.
Dieren werden verdeeld in drie groepen van drie verschillende concentraties voor elk type nanodeeltjes. Rekening houdend met zes ratten/groep voor intraveneuze route (gecodeerd als experiment A-set) en zes ratten/groep voor intraperitoneale route (gecodeerd als experiment B-set), volgens tabellen 1 en 2. In beide experimentsets groep A diende als controle (voertuig gedestilleerd water).
Observatie- en onderzoeksitems
Klinische symptomen
Tijdens de test werd één keer per dag na de behandeling geobserveerd om de tekenen van klinische toxiciteit en/of overlijden te controleren.
Voeder- en waterverbruik
Voer- en waterverbruik werd dagelijks geregistreerd na de startdatum van de behandeling, berekend uit de verschillen tussen de geleverde hoeveelheden en de resterende hoeveelheden.
Dierengedrag en lichaamsgewicht
Elke twee dagen na injectie werden ratten gewogen en beoordeeld op gedragsveranderingen.
Hematologische indexen
Met behulp van een standaard bloedafnametechniek in de saphena-ader werd bloed afgenomen voor hematologische analyse (met behulp van kalium-methyleendiaminetetra-azijnzuur-verzamelbuisjes). Volgens de standaard hematologische analyse werd 300 μl bloed van de rat verzameld en op 14 en 28 dagen werden de standaard hematologische parameters, dwz het aantal bloedplaatjes, hematocriet, hemoglobine, het aantal rode bloedcellen en het aantal witte bloedcellen, geanalyseerd [33].
Biochemie panelanalyse van serum
Om de biochemische serumspiegels te bepalen, waaronder de alanineaminotransferase (ALT/GPT), creatinine (CRE), aspartaataminotransferase (AST) en alkalische fosfatase (ALP), werden controle- en behandelde ratten opgeofferd en werden volbloedmonsters verzameld voor centrifugatie (3000 tpm ) gedurende 15 minuten. De beoordeling werd uitgevoerd door een automatische biochemische analysator voor monsters van 14 en 28 dagen [34].
Detectie van het gewicht van organellen
Na 14 en 28 dagen werden de ratten verdoofd door ether met fosfaatgebufferde zoutoplossing en werden ze ontleed. Organen van de controle- en behandelde groepen werden onmiddellijk geoogst. Hart, long, thymus, hersenen, nier, lever en milt werden zorgvuldig gescheiden en gewassen met natriumchloride-oplossing en gespoeld met ijskoud gedeïoniseerd water en gedroogd met filtreerpapier. Morfologie en kleur van ontlede organen werden onderzocht en het gewicht van elk orgaan werd gemeten. Om de mate van veranderingen te onderzoeken die expliciet worden veroorzaakt door Bio-Cu en ZnONP's, moet de orgelindex (O X ) werd afzonderlijk berekend met formule [35]:
$$ \mathrm{Organ}\ \mathrm{index}\ \left({\mathrm{O}}_{\mathrm{X}}\right)=\frac{\mathrm{Weight}\ \mathrm{of} \ \mathrm{experimenteel}\ \mathrm{orgaan}/\mathrm{gewicht}\ \mathrm{of}\ \mathrm{experimenteel}\ \mathrm{dier}}{\mathrm{Weight}\ \mathrm{of}\ \mathrm{control}\ \mathrm{orgel}/\mathrm{weight}\ \mathrm{of}\ \mathrm{control}\ \mathrm{animal}} $$Waar orgelindex (OX ) kan veranderen als:
Hartindex (HX ), Leverindex (LiX ), Miltindex (SX ), Longindex (LuX ), Nierindex (KX ), Thymus-index (TX ), Hersenindex (BX ).
Histologie
Eén rat van elke groep inclusief controle werd gefixeerd met 10% gebufferde formaline na bloeduitstortingen met fosfaatgebufferde zoutoplossing. Een klein stukje lever, nier, milt en hersenen werd gefixeerd met 10% formaline en ingebed in paraffine. Paraffineblokken werden in secties gesneden en verwerkt voor hematoxyline- en eosinekleuring. Gekleurde coupes werden waargenomen met behulp van helderveldmicroscopie [36].
Statistische analyse
Alle gegevens worden uitgedrukt in gemiddelde ± SD van het gemiddelde van de drie onafhankelijke experimenten; elk werd in drievoud uitgevoerd, N = 6 ratten per groep.
Resultaten en discussie
Synthese van Bio-CuNP's en Bio-ZnONP's werden uitgevoerd door extracellulaire enzymatische methode tijdens blootstelling van reactanten aan Enterococcus faecalis supernatant. FeSEM-analyse van Bio-CuNP's en Bio-ZnONP's kan worden gezien met een grootte variërend van 1 tot 100 nm in distributie (aanvullend bestand 1). TEM-analyse meldt de aanwezigheid van gebiosynthetiseerde CuNP's en ZnONP's met kernschaalmorfologie van 12-90 nm en bolvormig voor CuNP's [31] en ZnONP's variërend van 16 tot 96 nm [32] (aanvullend bestand 2).
Evaluatie van Bio-Cu en ZnONP's op mannelijke wistarratten werd onderzocht zonder teken van mortaliteit na behandeling met NP. Bovendien werd na de behandeling en tot het einde van de duur van het experiment frequent onderzoek van witte ontlasting gecontroleerd na i/v-toediening van Bio-CuNP's in een dosering van 9,5 tot 11,5 g/kg. Tussen de derde en vierde week lieten de met Bio-CuNP's behandelde ratten een significante stijging zien in het voer en het waterverbruik voor i/v was 9,5 μg/kg (IC50 ) en 11,5 g/kg (TLC), terwijl voor de i/p-route (dosisbereik:24,8 tot 30,3 g/kg) en controlegroepratten van de 3e tot de 4e week. Variatie in het lichaamsgewicht van ratten na i/v en i/ p toediening van Bio-CuNP's en Bio-ZnONP's werd weergegeven in tabellen 3 en 4. Verlaging en toename van het lichaamsgewicht zijn waardevolle indicatoren bij het beoordelen van de toxiciteit van een testmonster [37]. Eerdere rapporten bewezen in toxiciteitsstudies op 13,5 nm goud [33] en 100 nm zilver [38] NP's effect op het lichaamsgewicht door i/v injectie was minder dan i/p en orale toediening. Volgens Rhiouani et al., de geringe gewichtsafname na 4 dagen behandeling in alle behandelde groepen kan wijzen op nadelige effecten van toxische stoffen op de dieren [39].
Het is te zien dat i/v- en i/p-toediening van Bio-ZnONP's in de drie verschillende doses (NOAEC, IC50 en TLC) het lichaamsgewicht was tot de tweede week van toediening licht verlaagd in vergelijking met de controlegroep. Na de 14e dag was het lichaamsgewicht echter weer terug. In het geval van i/p-toediening werd een afname van het lichaamsgewicht veroorzaakt door Bio-ZnONP's (30,3 g/kg) bij een totale letale concentratie en was deze lager dan in de controlegroep, wat wijst op triviale toxiciteit via de i/p-route in plaats van de i/v-route (Tabel 4, Afb. 1a). Evenzo werd bij ratten behandeld met Bio-CuNP's, bij een concentratie van 9,5 g/kg en 11,7 μg/kg via i/v-route, een lichte vermindering van het lichaamsgewicht opgemerkt. Tot 14 dagen behandeling met Bio-CuNP's werden geen tekenen van nadelige effecten op groei en lichaamsgewichtstoename waargenomen. Variatie in lichaamsgewicht binnen 28 dagen bij een dosis van 11,7 μg/kg (i/v-route) wordt weergegeven in tabel 3. Na de 14e dag van de behandeling werd een aanzienlijke afname van het lichaamsgewicht via i/v-route gevonden in vergelijking met de controle groep. Geeft dus de toxiciteit van Bio-CuNP's via deze route aan (figuur 1b). Met Bio-CuNP's behandelde ratten via i/p-toediening veroorzaakten een lichte afname van het lichaamsgewicht en er werd geen teken van mortaliteit waargenomen bij zowel de i/p- als de i/v-route. Daarom induceerden i/p-injecties een lagere toxiciteit (weergegeven in tabel 4 en figuur 1a).
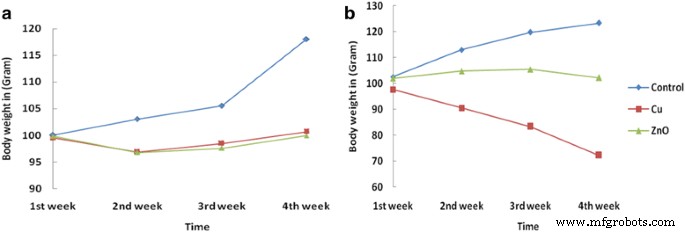
Verandering in lichaamsgewicht van onbehandelde (controle) en behandelde ratten met Bio-CuNP's en Bio-ZnONP's. Bio-CuNP's en Bio-ZnONP's behandeld via (A) intraperitoneale (i/p) en (B) intraveneuze (i/v) toedieningsweg tot de 28e observatiedag. Alle behandelingen van Bio-CuNP's (Cu) en Bio-ZnONP's (ZnO) in hun totale letale concentratie werden toegediend en 28 dagen in observatie gehouden; N = 6 ratten per groep
Hematologie-indexen
Schatting van hematologische parameters zoals RBC-telling, WBC-telling, bloedplaatjestelling, hemoglobineniveau en bloedstollingstijd zijn de belangrijke entiteiten om de toxiciteit van behandelde NP's te meten. Voor dag 14 en 28 worden de concentratieafhankelijke hematologische resultaten weergegeven in tabellen 5 en 6 voor de i/p- en i/v-toedieningsroute. Dosering van Bio-CuNP's bij 9,5 μg/kg (IC50 ) en 11,7 μg/kg (TLC) via i/v-route heeft een verlaagd aantal rode bloedcellen laten zien in tegenstelling tot Bio-ZnONP's. Een concentratieafhankelijke trend is echter niet opgemerkt. Voor ratten die via de i/v-toedieningsroute met Bio-ZnONP's werden behandeld, zijn het hemoglobinegehalte, het aantal bloedplaatjes en de witte bloedcellen veranderd, maar er wordt geen significant verschil waargenomen tussen alle drie de concentraties (NOAEC, IC50 en TLC). Maar in het geval van een i/p-toedieningsroute werd een significante afname en veranderingen in het aantal rode bloedcellen, witte bloedcellen, hemoglobinegehalte en aantal bloedplaatjes gevonden op de 14e observatiedag (tabel 5) in vergelijking met de controle en bio- CuNP's behandeld. Verrassend genoeg blijken hematologische effecten normaal te zijn op de 28e dag (tabel 6).
De hematologische effecten van de verschillende injectiemethoden (i/v, i/p) voor de twee verschillende Bio-NP's op de 14e en 28e dag van waarnemingen zijn divers. Er kan worden waargenomen dat hemoglobine, rode bloedcellen, witte bloedcellen en bloedplaatjes afnemen via de i/v-route bij behandeling met Bio-CuNPs en via de i/p-route bij met Bio-ZnONPs behandelde ratten. Maar de significante afname van het aantal rode bloedcellen werd waargenomen. Dit geeft aan dat de verschillende injectieroutes geen significante verschillen veroorzaakten in het aantal bloedplaatjes, hemoglobine of witte bloedcellen, behalve bij ratten die waren geïnjecteerd met Bio-CuNP's (i/v-route). Rode bloedcellen vertonen een significant verschil na i/p- en i/v-injectie (zoals weergegeven in tabellen 5 en 6).
Biochemische bepaling van serum
Serumcreatinine is een afvalproduct; hogere creatinineproductie duidt op nierbeschadiging. Bio-ZnONP's (i/v-route:dosering van 11-16 g/kg, i/p-route:dosering van 24-30 μg/kg) hadden geen significante invloed op het serumcreatininegehalte in vergelijking met controle op de 14e en 28e dag. (Tabellen 7 en 8, Afb. 2a, b). Ratten die werden behandeld met Bio-CuNP's (i/v-route:dosering van 06-12 g/kg) vertoonden een verhoging van het serumcreatininegehalte tot 2,3 mg/dl in vergelijking met controle. De i/p-injectieroute vertoonde echter geen significante veranderingen (tabellen 7 en 8). Het bloedserum bevat een groot aantal enzymen, maar om de normale en pathologische symptomen van lever te beoordelen, zijn alaninetransaminse (glutamaatpyruvaattransaminase) en aspartaattransaminasen (glutamaatoxalaatacetaattransaminase) nuttig. Aspartaattransaminase is van mitochondriale oorsprong en is in grote hoeveelheden aanwezig in lever, hart, nieren en skeletspieren. Serum alkalische fosfatase is een globuline-enzym met een laag molecuulgewicht, dat in hogere concentraties wordt aangetroffen in botten, lever- en galwegen en nieren. De activiteit van dit enzym kan worden bepaald door de schatting van organisch fosfaat dat vrijkomt uit het glycerolfosfaat. De serumspiegel van de enzymen was verhoogd bij zowel hepatocellulaire als obstructieve geelzucht. Bij de i/v-toedieningsroute hadden Bio-ZnONP's (40,7 mg/dl, 37,9 IE/l, 82,4 IE/l) geen significante effecten op serum-ALAT-, serum-AST- en ALP-spiegels in vergelijking met controle. Hoewel i / p-toediening een significante toename van het ALT-, AST- en ALP-niveau vertoonde in vergelijking met controle op de 14e en 28e dag (Fig. 2a en b). Resultaten van toxiciteitsstudies op serum toonden aan dat Bio-ZnONP's geen veranderingen in de niveaus van creatinine, ALT, AST en ALP voor i/v-route tot 28 dagen.
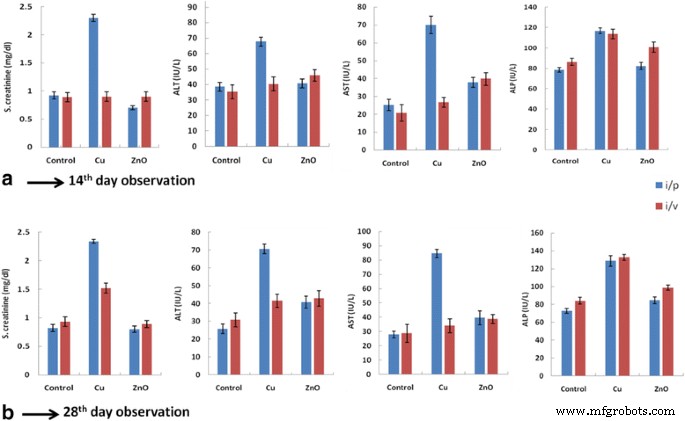
Biochemische resultaten van ratten behandeld met Bio-CuNP's en Bio-ZnONP's. S. creatinine-, ALT-, AST- en ALP-spiegels werden gemeten bij ratten die werden behandeld met Bio-CuNP's en Bio-ZnONP's via intraperitoneale (i/p) en intraveneuze (i/v) toedieningsweg op (A) 14e dag en (B) 28e dag. Alle gegevens worden uitgedrukt in gemiddelde ± SD van het gemiddelde van de drie onafhankelijke experimenten; elk werd in drievoud uitgevoerd, N = 6 ratten per groep. Opmerking:Cu:Bio-CuNP's, ZnO:Bio-ZnONP's, i/p:intraperitoneaal, i/v:intraveneus
Daarentegen vertoonden ratten die via i/v-route met Bio-CuNP's werden behandeld een significante toename van serum-ALAT (67,7 mg/dl), AST-niveau (70 IE/l) en ALP (128 IE/l). Het effect van Bio-CuNP's via de i/p-route was aanzienlijk laag in vergelijking met de controle. Het verschil in de resultaten kan worden toegeschreven aan verschil in doseringsroutes, toxiciteit van nanodeeltjes en de duur van toediening. We ontdekten dat Bio-ZnONP's geen effect hebben op biomarkers voor nier- en leverfunctie (zowel i/v als i/p) in vergelijking met Bio-CuNP's.
Detectie van het gewicht van de organellen en histologisch onderzoek
Veranderingen in het orgaangewicht van ratten bij verschillende Bio-NP's-doses illustreren de nadelige effecten van NP's op organen. Het is te zien dat het gewicht van het hart, de lever, de milt, de longen, de nieren en de hersenen bij ratten wordt verlaagd wanneer ze worden behandeld met Bio-ZnONP's, zoals weergegeven in de tabellen 9 en 10. Bovendien moet rekening worden gehouden met de orgaanreactie en de mate van veranderingen werden onderzocht door de orgelindex (OX ) van elk orgel afzonderlijk. De orgaanindex voor hart, lever, milt, long, nieren, hersenen en thymus wordt weergegeven in tabellen 9 en 10.
Verschil in het gewicht van milt en thymus werd waargenomen na toediening van i/v en i/p bij met Bio-CuNP's en Bio-ZnONP's behandelde ratten. Op de 14e dag vertoonden Bio-ZnONP's een verlaagde miltindex via i/p-injectie en verhoogd door i/v-toediening (tabel 9). In het geval van met Bio-CuNP's behandelde ratten via i/v-toediening vertoonden significante verlaging van de miltindex op de 14e (0,265) en 28e dag (0,49). Dit geeft aan dat het immuunsysteem is aangetast door i/v Bio-CuNPs-toediening en i/p Bio-ZnONPs-toediening. In het geval van i/p Bio-ZnONPs-toediening, keert het immuunsysteem van de rat terug naar de normale toestand na de 14e dag en bewijst dat het effect niet verlengd wordt. Samengenomen met de eerdere variatie in lichaamsgewicht, lijkt het erop dat de i/v-toedieningsroute van Bio-CuNP's het hart, de lever, de longen, de nieren en de hersenen kan beïnvloeden; bovendien kan het het immuunsysteem beschadigen. Uit figuur 3a blijkt dat milt en thymus het belangrijkste doelwit zijn van organen door Bio-CuNP's.
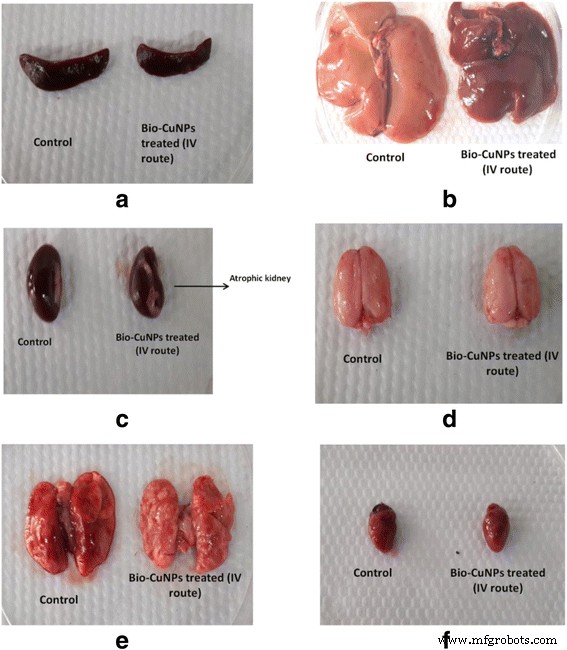
Verandering in organelmorfologie. Waar een milt, b lever, c nier, d hersenen, e longen en f hart, van mannelijke Wistar-ratten die via intraveneuze weg met Bio-CuNP's werden behandeld in vergelijking met controle op 28-daagse observatie
In het geval van met i/v en i/p Bio-CuNPs behandelde groepen zijn duidelijke effecten op de orgaanindex waargenomen bij beide IC50 en TLC-doses. Bovendien vertoont de intraperitoneale injectie van de twee verschillende toedieningsroutes de bescheiden toxiciteit in met Bio-ZnONPs behandelde groepen en de hoogste toxiciteit in met Bio-CuNPs behandelde groepen. Het was bekend dat efficiënte geneesmiddelabsorptie door i/p-injectie snel was vanwege de dichte bloedvaten en lymfe in het muriene peritoneum [40]. Dienovereenkomstig vertoont de intraveneuze injectie de minste toxiciteit in met Bio-ZnONP's behandelde groepen en de hoogste toxiciteit in met Bio-CuNP's behandelde groepen.
Toxicologische veranderingen bij ratten
We hebben geprobeerd de effecten van toxiciteit te onderzoeken, bij verschillende doses en tijdsintervallen van Bio-NP's. Weefsels behandeld met Bio-ZnONP's (i/v-route:doseringsbereik 11-16 g/kg, i/p-route:doseringsbereik 24-30 μg/kg) vertoonden geen veranderingen in de lever, nier, milt en hersenen in vergelijking met controleweefsels (Fig. 4, 5, 6 en 7). Necropsie-waarnemingen (autopsie:dissectief onderzoek van dode ratten) gaven aan dat alle organen van met Bio-NP's behandelde ratten de anatomische kenmerken vertoonden (bijv. kenmerken van kleur, vorm en grootte) die verwacht konden worden op basis van hun uiterlijk in onbehandeld dier. In vergelijking met Bio-ZnONP's vertoonden met Bio-CuNP's behandelde ratten meer significante veranderingen in anatomische kenmerken van nier-, lever-, milt- en hersenweefsel in tegenstelling tot controle (Fig. 4, 5, 6 en 7).
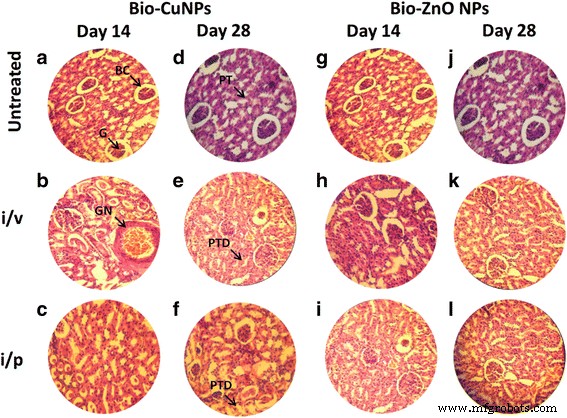
H &E-gekleurde secties van rattennier. Ratten behandeld via i/v- en i/p-route met Bio-Cu en ZnONP's; onbehandelde monsters werden als controle beschouwd. Waar secties behandeld met Bio-CuNP's werden waargenomen op dag 14 (A-C) en dag 28 (D-F). Met Bio-ZnONP's behandelde coupes op dag 14 (G-I) en dag 28 (J-L). BC Bowman-capsule, G glomerulair, PT proximale tubulus, GN glomerulaire necrose, PTD proximale tubulusschade
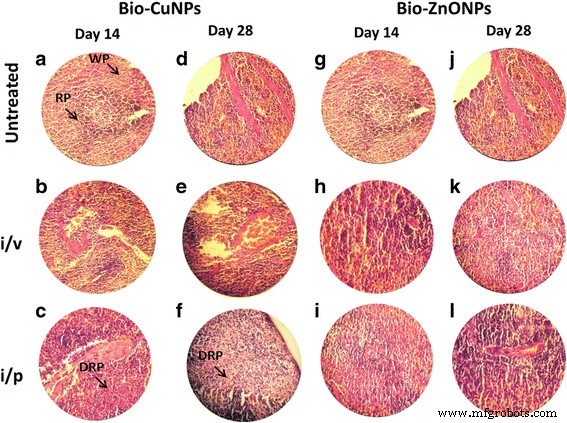
H &E-gekleurde secties van de milt van de rat. Ratten behandeld via i/v- en i/p-route met Bio-Cu en ZnONP's; onbehandelde monsters werden als controle beschouwd. Secties behandeld met Bio-CuNP's waargenomen op dag 14 (A-C) en dag 28 (D-F). Met Bio-ZnONP's behandelde coupes op dag 14 (G-I) en dag 28 (J-L). WP witte pulp, RP rode pulp, DRP afname in rode pulp
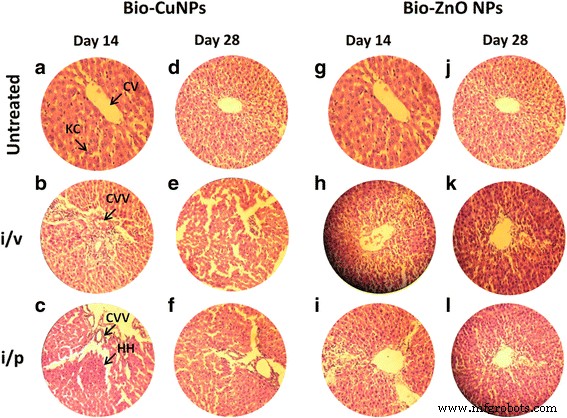
H &E-gekleurde secties van rattenlever. Ratten behandeld via i/v- en i/p-route met Bio-Cu en ZnONP's; onbehandelde monsters werden als controle beschouwd. Secties behandeld met Bio-CuNP's waargenomen op dag 14 (A-C) en dag 28 (D-F). Met Bio-ZnONP's behandelde coupes op dag 14 (G-I) en dag 28 (J-L). CV centrale ader, KC Kupffer-cellen, CVV centrale veneuze vacuolisatie (cytoplasmatische vacuolisatie), HH-leverbloeding
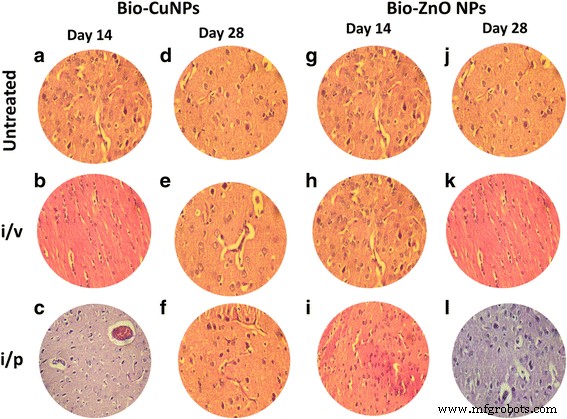
H &E-gekleurde secties van rattenhersenen. Ratten behandeld via i/v- en i/p-route met Bio-Cu en ZnONP's; onbehandelde monsters werden als controle beschouwd. Secties behandeld met Bio-CuNP's waargenomen op dag 14 (A-C) en dag 28 (D-F). Met Bio-ZnONP's behandelde coupes op dag 14 (G-I) en dag 28 (J-L). [Alle objectglaasjes worden bekeken onder een vergroting van × 40, NIKON eclipse E200 (Trinaculaire microscoop)]
Bio-CuNP's veroorzaakten schade via i/v-toediening en vertoonden een dosisafhankelijke trend in weefsels. Bij een TLC (11,7 g/kg) concentratie vertoonden Bio-CuNP's ernstige schade aan de lever en nierweefsels van Wistar-ratten. Bovendien hebben Bio-CuNP's die via zowel de i/v- als de i/p-route zijn behandeld, necrose van glomerulaire cellen (glomerulaire atrofie), bowman-capsule en proximale tubulaire geïnduceerde bij ratten van de 14e en 28e dag (Fig. 4b, e, c en f). ) in vergelijking met de onbehandelde controle. Glomerulaire necrose is te wijten aan immunologische terugbetaling, maar tubulusschade is meestal te wijten aan het toxische effect van de NP's. De tubulaire schade veroorzaakt door de toxische effecten van Bio-CuNP's via zowel de i/v- als de i/p-route verhoogde ook de glomerulaire druk en veroorzaakt glomerulaire atrofie.
De normale controlegroep vertoonde een normale histologische structuur van de leverkwab en de centrale ader die wordt omgeven door normale hepatocyten (Fig. 6). Bio-CuNP's behandeld via i / p-route (19,82 μg / kg) vertoonden milde histologische veranderingen, waaronder Kupffer-celactivering, zowel bij observatie op de 14e als de 28e dag (figuur 6b, e). Ratten die via i / v-route met Bio-CuNP's werden behandeld, vertoonden ernstige veranderingen, waaronder cytoplasmatische vacuolisatie van door centrale ader omgeven hepatocyten en leverbloeding voor observatie op de 14e dag (figuur 6c). Verrassend genoeg vertoonde de 28e-daggroep matige veranderingen, waaronder vetveranderingen van hepatocyten en pyknosis van hepatocytische kernen (figuur 6f). Leverweefsel behandeld met Bio-ZnONP's, voor de 14e dag van de i/p-route toegediende groep, vertoonde matige veranderingen die werden aangetoond door vetachtige veranderingen van hepatocyten (Fig. 6i). De met Bio-ZnONP's behandelde groepen vertoonden een lichte verbetering en significante hepatoprotectieve activiteit werd waargenomen op de 28e dag in vergelijking met de 14e dag (Fig. 6l). Vanaf de 14e dag heeft herstel van de normale leverarchitectuur plaatsgevonden bij met Bio-ZnONP's behandelde dieren.
Een afname van de miltcel (rode pulp), terwijl een toename van lymfocyten (witte pulp), in miltweefsel dat was geëxtraheerd uit ratten die waren behandeld met Bio-CuNP's via i / v-route (figuur 5c, f) werd opgemerkt. Bij primaire observatie werd aanwas van Bio-CuNP's in de milt opgemerkt in de rode pulp en was gerelateerd aan een bescheiden verlies van celmassa; reduced cell mass was obvious on the 28th day time point when compared with 14th day of i/v administration (Fig. 5f), whereas minor changes were observed in red pulp depletion when rats were treated with Bio-CuNPs via i/p route on both 14th and 28th day time point. Structural changes were not seen in the white pulp or in splenic blood vessels (arteries or venous sinuses) and intravascular erythrocytes (Fig. 5b, e). No morphological changes have been found in spleen tissues treated with Bio-ZnONPs (Fig. 5). The H&E-stained brain sections of rats, treated (i/v and i/p) with NPs, showed no changes in brain region, olfactory bulb (perivascular localization) and the choroid plexus and ependyma of the lateral ventricles (Fig. 7).
Conclusion
Animal toxicity studies using 16- to 96-nm-ranged biosynthesized copper (Bio-CuNPs) and zinc oxide (Bio-ZnONPs) was assessed in male Wistar rat at the dose range of 6.1 to 19.82 μg/kg and 11.14 to 30.3 μg/kg respectively for both i/p and i/v routes on 14th and 28th day of observation. We observed no mortality and normal behaviour in the animals treated with Bio-CuNPs and Bio-ZnONPs in their specific dose range. The results also verified the Bio-CuNPs and Bio-ZnONPs at low concentrations do not cause identifiable toxicity even after their breakdown in vivo over time. Increased concentrations of these Bio-NPs induce weight reduction, but no significant statistical difference was observed for Bio-ZnONPs’ treated animals. In the case of i/v and i/p Bio-CuNPs’ treated groups, obvious effects on organ index have been observed at both IC50 and TLC doses. Moreover, of the two different administration routes, the intraperitoneal injection shows the modest toxicity in Bio-ZnONPs’ treated groups and highest toxicity in Bio-CuNPs’ treated groups. Correspondingly, the intravenous injection shows the least toxicity in Bio-ZnONPs’ treated groups and highest toxicity in Bio-CuNPs’ treated groups. Considering all the results of studies, targeting Bio-ZnONPs by intravenous injection is promising for possible biomedical application.
Afkortingen
- ±:
-
Plus or minus
- ALP:
-
Alkaline phosphatase
- ALT:
-
Alanine aminotransferase
- AST:
-
Aspartate aminotransferase
- Bio-CuNPs:
-
Biogenic copper nanoparticles
- Bio-ZnONPs:
-
Biogenic zinc oxide nanoparticles
- BX :
-
Brain index
- CRE:
-
Creatinine
- Cu:
-
Copper
- FesEM:
-
Veldemissie scanning elektronenmicroscopie
- H&E:
-
Haematoxylin eosin
- Hb:
-
Haemoglobin
- HX :
-
Heart index
- i.e.:
-
That is
- i/p route:
-
Intraperitoneal route
- i/v route:
-
Intravenous route
- IC:
-
Inhibitory concentration
- KX :
-
Kidney index
- LiX :
-
Liver index
- LuX :
-
Lung index
- NOAEC:
-
No observable adverse effect concentration
- NP's:
-
Nanodeeltjes
- Ox :
-
Organ index
- RBC:
-
Red blood cell
- SD:
-
Standard deviation
- SX :
-
Spleen index
- TEM:
-
Transmissie-elektronenmicroscopie
- TLC:
-
Total lethal concentration
- TX :
-
Thymus index
- WBC:
-
White blood cell
- ZnO:
-
Zinkoxide
Nanomaterialen
- Biocompatibele FePO4-nanodeeltjes:medicijnafgifte, RNA-stabilisatie en functionele activiteit
- Biogene synthese, karakterisering en antibacteriële potentiële evaluatie van koperoxide-nanodeeltjes tegen Escherichia coli
- Met resveratrol geladen albumine-nanodeeltjes met verlengde bloedcirculatie en verbeterde biocompatibiliteit voor zeer effectieve gerichte pancreastumortherapie
- Nieuwe biocompatibele Au Nanostars@PEG-nanodeeltjes voor in vivo CT-beeldvorming en eigenschappen voor nierklaring
- Bioveiligheid en antibacterieel vermogen van grafeen en grafeenoxide in vitro en in vivo
- Gemodificeerd hypervertakte polyglycerol als dispergeermiddel voor groottecontrole en stabilisatie van gouden nanodeeltjes in koolwaterstoffen
- Synthese en in vitro prestaties van met polypyrrool gecoate ijzer-platina nanodeeltjes voor fotothermische therapie en foto-akoestische beeldvorming
- Groene bekwaamheid in de synthese en stabilisatie van kopernanodeeltjes:katalytische, antibacteriële, cytotoxiciteits- en antioxidantactiviteiten
- Een vergelijkend in vivo onderzoek van gebiosynthetiseerde koper- en zinkoxide-nanodeeltjes via intraperitoneale en intraveneuze toedieningsroutes bij ratten
- Groene synthese van metaal- en metaaloxidenanodeeltjes en hun effect op de eencellige alg Chlamydomonas reinhardtii
- Onderkoeling van water gecontroleerd door nanodeeltjes en ultrageluid



