Zure peptiserende agent-effect op anatase-rutielverhouding en fotokatalytische prestaties van TiO2-nanodeeltjes
Abstract
TiO2 nanodeeltjes werden gesynthetiseerd uit titaniumisopropoxide door een eenvoudige peptisatiemethode met zwavelzuur, salpeterzuur en azijnzuur. Het effect van peptiserend zuur op de fysisch-chemische en fotokatalytische eigenschappen van TiO2 poeders werd bestudeerd. De structurele eigenschappen van gesynthetiseerd TiO2 poeders werden geanalyseerd met behulp van XRD, TEM, N2 -fysisorptie, Raman, DR UV-vis , FTIR en röntgenfoto-elektronspectroscopietechnieken. De karakteriseringsresultaten toonden aan dat peptisering met azijnzuur de vorming van zuivere anatasefase vergemakkelijkte na thermische behandeling bij 500 °C; daarentegen leidde peptisering met salpeterzuur tot een belangrijke vorming van de rutielfase (67%). Interessant is dat het met zwavelzuur gepeptiseerde monster 95% anatase- en 5% rutielfasen opleverde. De fotokatalytische activiteit van gesynthetiseerd TiO2 nanodeeltjes werden geëvalueerd op afbraak van geselecteerde organische kleurstoffen (kristalviolet, methyleenblauw en p -nitrofenol) in waterige oplossing. De resultaten bevestigden dat de TiO2 monster gepeptiseerd met salpeterzuur (met rutiel- en anatasefasen in een verhouding van 3:1) bood de hoogste activiteit voor de afbraak van organische kleurstoffen, hoewel TiO2 monsters die met zwavelzuur en azijnzuur waren gepeptiseerd, hadden een kleinere deeltjesgrootte, een hogere bandafstand-energie en een groot oppervlak. Interessant is dat TiO2 monster gepeptiseerd met salpeterzuur had een relatief hoge theoretische fotostroomdichtheid (0,545 mAcm −2 ) en poriediameter (150 Å), die verantwoordelijk zijn voor een hoge efficiëntie van elektron-gatscheiding en diffusie en massatransport van organische reactanten tijdens het fotochemische afbraakproces. De superieure activiteit van TiO2 monster gepeptiseerd met salpeterzuur is te wijten aan de effectieve overdracht van fotogegenereerde elektronen tussen rutiel- en anatasefasen.
Achtergrond
Titaandioxide (TiO2 ) is een algemeen bekend halfgeleidermateriaal voor gebruik in vele toepassingen, waaronder omzetting van zonne-energie, verontreinigingsbeheersing en fotokatalyse [1,2,3]. TiO2 heeft over het algemeen drie polymorfen, namelijk anatase, rutiel en brookiet. Er werd gemeld dat anatase en brookiet kunnen worden omgezet in rutiel na thermische behandeling bij hoge temperatuur (<-610 ° C) [4, 5]. TiO2 Van anatase is bekend dat het een actieve fotokatalysator is voor de afbraak van organische verontreinigende stoffen [1, 5,6,7,8]. Er werd waargenomen dat de grootte, kristallijne fase en porositeit van de TiO2 monsters hebben een sterke invloed op hun toepassingen [9]. Synthese bij lage temperatuur van poreus TiO2 . met nanogrootte vereist langere synthesetijden [10,11,12]. Li et al. [13] synthetiseerde pure anatase en mengsel van rutiel- en anatasefasen door het amorfe TiO2 thermisch te behandelen . De vorming van zuivere anatase omvat thermische behandeling bij hoge temperatuur (500 ° C) [14], wat vaak leidt tot sinteren van de TiO2 nanostructuren. Synthese van zuivere kristallijne anatase bij lagere temperaturen is een interessant onderzoeksonderwerp [15]. Sol-gel en hydrothermische synthesemethoden [16] werden gebruikt om een goed kristallijne TiO2 bij lage temperatuur en korte reactietijd [17]. Wang et al. [12] gesynthetiseerd zeer kristallijne anatase en rutiel nanodeeltjes door hydrothermale HNO3 gepeptiseerde TiO2 sols. De hydrothermische methode vereist echter speciale syntheseomstandigheden en dure apparatuur die hoge pH en temperaturen kan verdragen [18].
De sol-gel-synthesemethode werd gebruikt door het titaniumalkoxide als Ti-precursor bij een milde temperatuur (<-100 °C) te gebruiken en het leverde zeer gedispergeerde TiO2 in nanogrootte op. monsters [16]. De chemische peptiseringsmethode is aangepast voor de synthese van stabiele metaaloxide-nanostructuren, waaronder TiO2 [19], waar de gecoaguleerde suspensie oplost en herkristalliseert tot de stabiele oplossing van nanodeeltjes met het peptiseermiddel [20]. Er werd gerapporteerd dat de aard van peptiserend zuur een effect heeft op de fysisch-chemische eigenschappen zoals kristallietgrootte, samenstelling en morfologie van deeltjes [21]. Zaban et al. [22] gesynthetiseerde TiO2 colloïden met HNO3 en CH3 COOH onder hydrothermische omstandigheden en observeerde in beide gevallen de vorming van anatase en brookietmengsel. Liu et al. [23] behaalde TiO2 hydrosol uit metatitaanzuur onder verschillende peptiseermiddelen en bestudeerde de invloed van peptiseercondities op de structurele en fotokatalytische eigenschappen van TiO2 hydrosolen. Kanna en Wongnawa [24] gebruikten de sol-gel-synthesemethode om amorf-anatase-rutiel te verkrijgen door verschillende zuren te gebruiken, zoals HCl, HNO3 , H2 SO4 , H3 PO4 , en CH3 COH. De auteurs merkten op dat de aanwezigheid van sulfaat- en fosfaatgroepen verantwoordelijk zijn voor de remming van de groei van de rutielfase. Later, Alphonse et al. [25] gesynthetiseerde TiO2 aggregaten, die zijn samengesteld uit anatase en brookietfase door hydrolyse van titaanisopropoxide in een zeer zuur milieu. Parra et al. [26] bestudeerde de reactieroute bij de synthese van anatase-nanodeeltjes met azijnzuur. Ze gebruikten FTIR- en NMR-technieken om te concluderen dat acetaationen fungeren als tweetandige ligand tussen twee Ti-centra.
Zhou et al. [27] bestudeerde het effect van HCl, HNO3 , en CH3 COOH in solvothermische methode om 3D TiO2 . te synthetiseren structuren met verschillende morfologie. De auteurs concludeerden dat het met 0,68 M HCl gesynthetiseerde monster zowel anatase- als rutielfasen bezat en de hoogste fotokatalytische activiteit bood vanwege de unieke morfologie en optische eigenschappen. Tobaldi et al. [28] aangenomen gecontroleerde hydrolyse/peptisatie van titaniumisopropoxide met HNO3 , HBr en HCl om TiO2 . te synthetiseren nanodeeltjes. Er werd waargenomen dat halogenide-ionen de overgang van de anatase-naar-rutielfase versterkten, en de monsters bevatten tot 77 gew.% rutiel en 5 gew.% brookiet na calcineren bij 450 °C.
In eerdere publicatie [29], synthese van nanogrootte TiO2 poeders door zure peptisering van xerogels onder atmosferische vochtigheidsomstandigheden werd uitgevoerd. Er werd waargenomen dat de zure peptisatie vergezeld van ultrasone trillingen een effect heeft op TiO2 structurele eigenschappen. Er waren echter slechts enkele studies gewijd aan het bestuderen van het effect van peptiseringscondities op de vorming van de rutielfase en het daaropvolgende effect op de fotokatalytische activiteit van TiO2 nanodeeltjes. In dit artikel onderzochten we de invloed van de aard van peptiserend zuur (H2 SO4 , HNO3 , en CH3 COOH) over de vorming van de rutielfase en de invloed ervan op de fotokatalytische efficiëntie van TiO2 nanodeeltjes bij de afbraak van drie verschillende organische verontreinigende stoffen (kristalviolet (CV), methyleenblauw (MB) en p -nitrofenol (p -NP)).
Methoden
Bereiding van TiO2-nanodeeltjes met behulp van verschillende peptiserende zuren
Titaantetra-isopropoxide [Ti(OPri)4 ] werd gebruikt als Ti-precursor en de hydrolyse van Ti(OPri)4 werd uitgevoerd onder standaard atmosferische omstandigheden [29]. De typische syntheseprocedure kan als volgt worden beschreven:50 ml Ti(OPri)4 werd in een donkere glazen fles gedaan en de fles werd 15 dagen in de zuurkast gelaten. De temperatuur en vochtigheid van de zuurkast werden gemeten als respectievelijk 25 ± 5 °C en 50 ± 10%. De hydrolyse van de Ti-precursor was in 15 dagen voltooid en de resulterende oplossing werd omgezet in een gel, die vervolgens werd gedroogd om xerogel te verkrijgen. Het peptiserend zuur (100 ml van 1 N CH3 COOH of HNO3 of H2 SO4 ) werd in een glazen beker gepipetteerd en de bekende hoeveelheid amorf xerogelpoeder (2,0 g) werd langzaam onder constant roeren aan het peptiseerzuur toegevoegd. Vervolgens werd de beker in een ultrasoonbad geplaatst dat op 40°C werd gehouden, en het mengsel werd gedurende 10 minuten aan ultrasone behandeling onderworpen. De gepeptiseerde TiO2 nanodeeltjes werden verzameld na centrifugatie. Vervolgens werden de materialen gewassen met gedestilleerd water en 3 uur gecalcineerd bij 500 ° C. De gesynthetiseerde monsters werden gelabeld als TiO2 acroniem voorvoegsel na hun peptizing zuur als "ace", "nit" en "sul" overeenkomend met CH3 COOH, HNO3 , en H2 SO4 , respectievelijk.
Materiaalkarakterisering
De poederröntgendiffractieprofielen werden verzameld met behulp van een Philips PW1700-diffractometer met Cu Ka-straling en grafietmonochromator met automatische divergerende spleet. De XRD-profielen werden geïndexeerd met standaard JCPDS-gegevens. Spurr en Myers [30] formule [Vgl. (1)] werd gebruikt om de gewichtsfracties van anatase- en rutielfasen te bepalen.
$$ {X}_{\mathrm{R}}=1/\left[1+k\ \left({I}_{\mathrm{A}}/{I}_{\mathrm{R}}\ rechts)\rechts] $$ (1)waar ik A en ik R zijn de geïntegreerde intensiteiten van respectievelijk (101) reflectie van anatase en (110) reflectie van rutiel. De empirische constante k werd in dit werk als 0,80 genomen. De kristallietgrootte van de gesynthetiseerde monsters werd gemeten met behulp van de Scherrer-formule [Vgl. (2)] en anataas (101) en rutiel (110) reflecties.
$$ D=B\lambda /{\beta}_{1/2}\cos \theta $$ (2)waar D is de gemiddelde kristallietgrootte van de fase, B is de constante van Scherrer (0,89), λ is de golflengte van de röntgenstraling (1.54056 Å), β 1/2 is de volledige breedte op het halve maximum van de reflectie, en θ is de diffractiehoek.
TEM-analyse van de monsters werd uitgevoerd met een Philips CM200FEG-microscoop uitgerust met een veldemissiekanon bij 200 kV. De coëfficiënt van sferische aberratie Cs = 1.35 mm werd toegepast. HRTEM-beelden met een pixelgrootte van 0,044 nm zijn gemaakt met een CCD-camera. De laser Raman-spectraalanalyse van de monsters werd uitgevoerd met behulp van Bruker Equinox 55 FT-IR-spectrometer uitgerust met een FRA106/S FT-Raman-module en een vloeibare N2 -gekoelde Ge-detector met behulp van de 1064 nm-lijn van een Nd:YAG-laser met een uitgangslaservermogen van 200 mW.
N2 -fysisorptiemetingen werden uitgevoerd met behulp van het ASAP 2010-instrument, Micromeritics Instrument Corporation, VS. Specifiek oppervlak (S BET ) van de monsters werd gemeten met N2 -adsorptiewaarden en de BET-vergelijking. De poriebreedte en het porievolume van de monsters werden bepaald door toepassing van de BJH-methode.
Diffuus reflectie UV-vs spectra voor gesynthetiseerde TiO2 monsters werden opgenomen met behulp van Thermo Scientific Evolution-spectrofotometer in het golflengtebereik van 220-700 nm. Band gap-energie van de monsters werd bepaald met behulp van Kubelka-Munk-transformatie (K ) zoals gepresenteerd in Vgl. (3).
$$ K=\frac{{\left(1-R\right)}^2}{2R} $$ (3)waar R is de reflectie. De golflengten (nm) werden vertaald in energieën (eV), en een grafiek van \( {\left(\mathrm{Kh}\upnu \right)}^{0.5} \)vs. hν werd getrokken. De band gap-energie (eV) werd geschat als het snijpunt van de twee hellingen van de getekende curve.
De röntgenfoto-elektronenspectra van de monsters werden verzameld met behulp van het Thermo Scientific Escalab 250 Xi XPS-instrument met Al Kα-röntgenstralen met een vlekgrootte van 650 mm. De piekverschuiving als gevolg van ladingscompensatie werd gecorrigeerd met behulp van de bindingsenergie van C1s hoogtepunt. De gegevens zijn verkregen met een doorlaatenergie van 100 eV, een verblijftijd van 200 ms met een stapgrootte van 0,1 eV en 10–30 scans.
Fotokatalytische afbraak van kristalviolet, methyleenblauw en p -Nitrofenol
De fotokatalytische afbraak van CV, MB en p -NP-experimenten werden uitgevoerd in een glazen reactor met behulp van gesynthetiseerde TiO2 monsters als fotokatalysator onder UV-straling voor verschillende reactietijden. Er werden in totaal zes zwarte UV-lampen (F20 T8 BLB) met een vermogen van 18 W en afmetingen van 60 × 2,5 cm gebruikt. Het totale vermogen van de UV-straling aan het oppervlak van een waterige organische kleurstofoplossing werd gemeten met een Newport 918DUVOD3-detector en de vermogensmeter werd gemeten als 13 Wm −2 . Honderd milligram katalysator werd toegevoegd aan 100 ml waterige organische verontreinigende stof (10 ppm) oplossing. Voorafgaand aan de evaluatie van de fotokatalytische efficiëntie van de katalysator, werd de organische kleurstofoplossing in evenwicht gebracht met de katalysator door 45 minuten te roeren om de adsorptie van organische kleurstof op het oppervlak van de katalysator te stabiliseren. De fotokatalytische afbraak van CV, MB en p -NP werd gevolgd door de absorptie van organische kleurstof met een regelmatig tijdsinterval te meten met behulp van een Thermo Fisher Scientific Evolution 160 UV-vis spectrofotometer. Het degradatiepercentage werd berekend met behulp van de uitdrukking
$$ \eta =\left(1-C/{C}_0\right)\times 100 $$ (4)Waar C 0 is de concentratie van organische kleurstof vóór verlichting en C is de concentratie na een bepaalde reactietijd.
De stabiliteit van de fotokatalysatoren werd geanalyseerd door middel van herbruikbaarheidsexperimenten. De regeneratie van de katalysator werd uitgevoerd met een eenvoudige procedure. Na de eerste cyclus van activiteitsmeting werd de katalysator door middel van centrifugatie uit de fotoreactor en de porties gefiltreerd. De verkregen katalysator werd grondig gewassen met gedestilleerd water en aceton. De katalysator werd 2 uur bij 50°C gedroogd en vervolgens hergebruikt voor de volgende cyclus van de fotokatalysemetingen. Evenzo werd het experiment verschillende cycli herhaald om de stabiliteit van de katalysator te bestuderen.
Resultaten en discussie
Röntgenpoederdiffractie
De röntgendiffractiepatronen van gecalcineerd TiO2 -ace, TiO2 -nit, en TiO2 -sul-monsters worden weergegeven in Fig. 1. De XRD-piekposities en -intensiteiten voor TiO2 fasen die in de monsters worden gepresenteerd, worden aangevuld met de JCPDS-database. Het is bekend dat de anatasefase grote diffractiepieken vertoont bij 2θ waarden van 24,8°, 37,3°, 47,6°, 53,5°, 55,1° en 62,2° overeenkomend met (101), (004), (200), (105), (211) en (204) kristalvlakken [JCPDS nr. 21-1272]. Aan de andere kant vertoont de rutielfase grote diffractiepieken bij 2θ waarden van 27,0°, 35,6°, 40,8°, 54,0°, 53,9°, 56,1° en 61,0° wat overeenkomt met kristalvlakken van (110), (101), (200), (111), (210), ( 211), (220), (002), en (310) [JCPDS nr. 21-1276]. De kristallietgrootte en gewichtsfracties van anatase- en rutielfasen die in de monsters werden gepresenteerd, werden bepaald met respectievelijk de Scherrer-formule en de Spurr- en Myers-methode. Het poeder XRD-patroon van TiO2 -ace-monster toonde aan dat het is samengesteld uit pure anatasefase (100%) met een deeltjesgrootte van 48 nm (tabel 1).
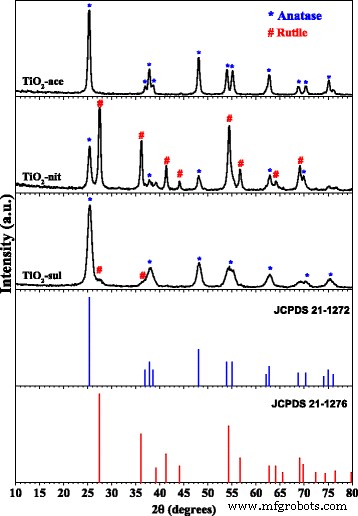
Poeder XRD patronen van de gecalcineerde TiO2 voorbeelden (overgenomen met toestemming van [29]. Copyright @ Elsevier 2017)
De TiO2 -sul-monster bezat voornamelijk anatasefase (95%) met een deeltjesgrootte van ongeveer 23 nm; in dit monster is echter een kleine diffractiepiek te zien die overeenkomt met (110) vlak van de rutielfase. In tegenstelling, TiO2 -nit-monster vertoonde XRD-reflecties voor zowel anatase- als rutielfasen met een kristallietgrootte van respectievelijk 41 nm en 50 nm. Opgemerkt wordt dat het rutiel de belangrijkste fase (67%) is in dit monster. Deze resultaten geven aan dat de aard van peptiserend zuur een rol speelt bij de vorming van TiO2 fase.
Hoge resolutie transmissie-elektronenmicroscopie
TEM werd uitgevoerd om de grootte van de deeltjes, kristalliniteit en morfologie van gesynthetiseerd TiO2 te onderzoeken nanopoeders. De TEM- en HRTEM-foto's van gesynthetiseerde TiO2 nanopoeders worden weergegeven in Fig. 2. Het is te zien dat de TiO2 -sul-monster bestaat uit dicht opeengepakte geagglomereerde anataasdeeltjes met een geschatte gemiddelde korrelgrootte van ongeveer 7 nm. De TiO2 -nit-monster bezat nanodeeltjes met een grootte tussen 10 en 20 nm met sferische morfologie en ook grote vellen met een breedte van 20 nm. In tegenstelling, TiO2 -ace monster bestaat uit TiO2 nanodeeltjes (15-20 nm) bestonden uit voornamelijk gedefinieerde bolvormige morfologie. Vinogradov en Vinogradov [31] observeerden ook het vergelijkbare type resultaten dat de kleine aggregaten werden gedetecteerd wanneer sterke peptiserende zuren zoals HNO3 en H2 SO4 werden gebruikt voor de peptisering. De kristallietgrootte gemeten met de formule van Scherer resulteerde in grotere kristallietgroottes in vergelijking met de korrelgrootte gemeten met TEM-analyse. Zoals eerder gemeld, verschilt de kristallietgrootte van de korrelgrootte; in sommige gevallen kan de kristallietgrootte echter overeenkomen met de korrelgrootte [32]. Opgemerkt kan worden dat de HRTEM-beelden van TiO2 -sul en TiO2 -ace-monsters toonden deeltjes die franjes bevatten die overeenkomen met anatase-kristalroostervlakken met d -afstand van 0,356 nm voor het (101) vlak [33], terwijl het HRTEM-beeld van TiO2 -nit monster toonde deeltjes met roosterranden voor rutiel kristalroostervlak (110) met d -afstand van 0,325 nm samen met het anataaskristalrooster (101) vlak.

TEM- en HRTEM-beelden van de gecalcineerde TiO2 voorbeelden
Raman-spectroscopie
Raman-spectroscopie werd ook gebruikt om de fasevorming in het gesynthetiseerde TiO2 . te onderzoeken monsters. Afbeelding 3 toont Raman-spectra verkregen voor de drie TiO2 monsters gecalcineerd bij 500 ° C. Het is gemeld dat anatase- en rutielfasen respectievelijk zes en vijf actieve Raman-banden hadden (anatase 143, 195, 395, 512 en 638 cm −1 ; rutiel 145, 445, 611 en 826) [34]. Uit figuur 3 blijkt duidelijk dat alle drie de samples een zeer intense scherpe Raman-band vertoonden (E g ) in het bereik van 141-146 cm −1 , wat een karakteristieke band is vanwege de aanwezigheid van anatasefase. Lage intense Raman-banden als gevolg van zowel anataas- als rutielfasen kunnen duidelijk worden waargenomen in de inzetfiguur. De TiO2 -nit en TiO2 -sul-monsters vertoonden Raman-banden vanwege zowel anatase- als rutielfasen; de intensiteit van Raman-banden vanwege de aanwezigheid van de rutielfase is echter hoog in het geval van TiO2 -niet monster. In tegenstelling, TiO2 -ace-monster vertoonde alleen Raman-banden vanwege de anataasfase.
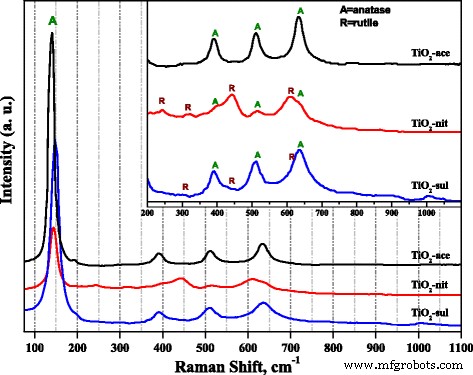
Raman-spectra van het gecalcineerde TiO2 voorbeelden
Er werd gemeld dat Raman-spectroscopieresultaten zouden kunnen worden gebruikt om de deeltjesgrootte van TiO2 te onderzoeken. nanodeeltjes, aangezien een ongebruikelijke bandverschuiving van Raman-banden kan worden gecorreleerd met een afname van de deeltjesgrootte van de monsters [35]. In Fig. 3, de TiO2 -ace monster vertoonde E g band op 141,5 cm −1 ; de band is echter verschoven naar 146 en 150 cm −1 in het geval van TiO2 -nit en TiO2 -sul monsters, respectievelijk. De waarnemingen van Raman-spectra geven aan dat TiO2 -sul-monster had een kleine deeltjesgrootte dan de andere twee monsters, wat in overeenstemming is met XRD- en TEM-waarnemingen.
Diffuse-reflectie UV-vis
De DR UV-vis spectra van de gesynthetiseerde TiO2 monsters die thermisch zijn behandeld bij 500 °C werden getoond in Fig. 4. De positie van het piekmaximum in de afgeleide van de DR UV-vis spectra voor drie monsters werd getoond in de inzet van de figuur. Het laat duidelijk zien dat de monsters een sterke elektronische reflectie hebben in het UV-gebied. Het maximale reflectiepiek is anders voor de monsters die zijn gesynthetiseerd met behulp van drie verschillende zuren. De TiO2 -sul-monster vertoonde een piekmaximum bij 372 nm, terwijl het is verschoven naar 383 nm in TiO2 -ace en 402 nm voor TiO2 -nit monster, respectievelijk. Het is gemeld dat de anatase en het rutiel een band gap-energie hebben van respectievelijk 3,2 eV (380 nm) en 3,0 eV (415 nm) [1]. De verschillen in reflectiemaximum kunnen worden toegeschreven aan de verandering van kristallietgrootte en fasestructuur van de monsters [36]. Het absorptiemaximum verschoof naar hogere golflengten voor de monsters die een hoger percentage rutielfase hebben. De band gap-energie (eV) werd berekend voor de gecalcineerde monsters door de relatie tussen hν en (αhν) [2] [Aanvullend bestand 1:Figuur S1] te bepalen. Uit de gegevens bleek dat de bandgap-energie voor TiO2 -sul (3,12 eV) is hoger in vergelijking met TiO2 -ace (2,99 eV) en TiO2 -nit (2,97 eV). De band gap van TiO2 neemt af wanneer de rutielfase wordt gedomineerd in het monster. Er werd gemeld dat de valentieband (VB) van anatase- en rutielfasen grotendeels te wijten is aan O2p staten; aan de andere kant is de geleidingsband (CB) samengesteld uit Ti 3d staten [37]. De band gap-energie van TiO2 wordt bepaald door de CB- en VB-posities, die sterk worden beïnvloed door de fasesamenstelling. Dus de band gap-energie van het monster dat zowel anataas- als rutielfasen bevat, moet tussen de waarden van pure anatase en rutiel liggen.
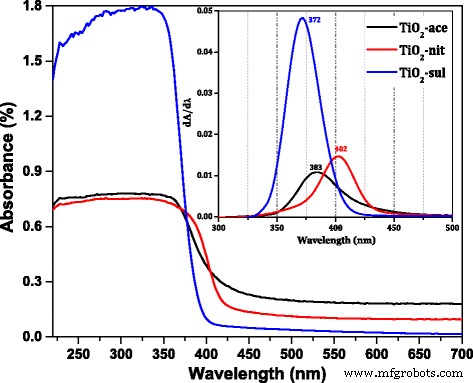
DR UV-vis spectra van de gecalcineerde TiO2 monsters (inzet; de afgeleide van de DR UV-vis spectrum)
N2 -Fysorptiemetingen
Stikstofadsorptie-desorptie-isothermen voor de drie gesynthetiseerde monsters worden weergegeven in figuur 5a. Type-IV isothermen met hysteresislus van het type H2 werden waargenomen voor de monsters die waren gesynthetiseerd door peptisatie met azijnzuur (TiO2 -ace) en zwavelzuur (TiO2 -sul). Dit geeft aan dat deze twee monsters mesoporiën bezitten die het resultaat zijn van de aggregaten van TiO2 nanodeeltjes. Voor TiO2 werd echter een typische type IV-isotherm met een smalle hystereselus van het H3-type (karakteristiek voor open en/of spleetvormige poriën) waargenomen. -niet monster. Er kan ook worden waargenomen dat de hysteresislus gesloten was bij hoge relatieve druk (P/P 0 = 1) en deze waarneming wijst op de aanwezigheid van poriën met grote afmetingen [38].
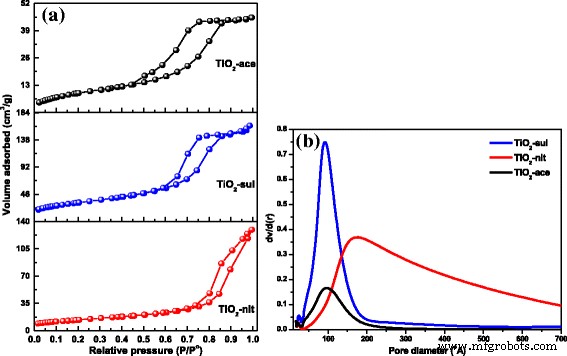
een N2 adsorptie-desorptie isothermen. b Poriëngrootteverdeling voor de gecalcineerde TiO2 voorbeelden (overgenomen met toestemming van [29]. Copyright @ Elsevier 2017)
De poriegrootteverdelingen van het BJH-model voor de gesynthetiseerde materialen werden verkregen uit de waarden van de adsorptietak van de isothermen. De BJH-poriegrootteverdelingen van de monsters worden getoond in figuur 5b. Smalle monomodale poriegrootteverdelingen werden waargenomen voor TiO2 -ace en TiO2 -sul monsters. Er werd echter een bredere poriediameterverdeling waargenomen voor het monster bereid met salpeterzuur, waarschijnlijk als gevolg van lege ruimten tussen grotere deeltjes. De textuureigenschappen van de monsters worden weergegeven in Tabel 1. De resultaten toonden aan dat een groot oppervlak (115 m 2 g −1 ) werd waargenomen voor de TiO2 - aasmonster gecalcineerd bij 500 °C. De volgorde van S BET verandering was TiO2 -ace> TiO2 -sul> TiO2 -niet. De waargenomen resultaten geven duidelijk aan dat de aangepaste peptiseringsomstandigheden zeer effectief waren bij het genereren van nanodeeltjes met een poreuze textuur.
Fourier Transform Infraroodspectroscopie
De fotokatalytische activiteit van TiO2 hangt af van kristalliniteit, kristallietgrootte, samenstelling, elektron-gat-recombinatiesnelheid, oppervlakte en ook de dichtheid van oppervlaktehydroxylgroepen [39]. FTIR- en XPS-spectroscopische technieken werden gebruikt om de aard van –OH-groepen in het gecalcineerde TiO2 te onderzoeken. monsters. Afbeelding 6 toont FTIR-spectra voor de drie TiO2 monsters in het bereik van 1600–4000 cm −1 . Het is gemeld dat TiO2 drager zou verschillende typen hydroxylgroepen aan het oppervlak kunnen bezitten; ze kunnen worden gecategoriseerd als geïsoleerde Ti-OH, hydroxylgroepen die aan elkaar zijn gebonden via waterstofbinding en chemisch gebonden H2 O-moleculen [40].
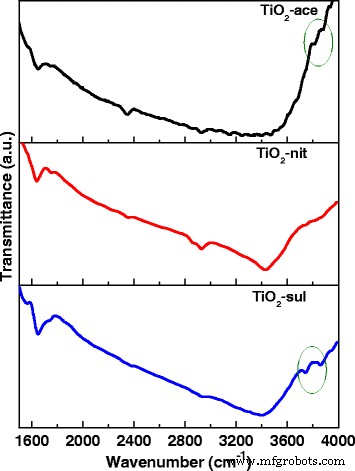
FTIR-spectra van het gecalcineerde TiO2 voorbeelden
De drie monsters toonden een brede band gecentreerd op 3408 cm −1 , die wordt toegeschreven aan de rektrilling van O-H-groepen (watermoleculen en de vrije oppervlakte-OH-groepen). Er verschenen ook extra banden op 2340 en 1640 cm −1 , wat kan worden toegeschreven aan O-H strektrillingen en moleculair geadsorbeerde H2 O, respectievelijk [41]. Een bestaan van twee –OH strektrillingen in het geval van anataas (bij 3715 en 3675 cm −1 ) en één zwakke band op 3680 cm −1 met rutiel werden eerder gerapporteerd [42]. Een zeer vergelijkbaar resultaat kan worden gezien in het geval van gesynthetiseerde TiO2 voorbeelden.
Röntgenfoto-elektronenspectroscopie
Afbeelding 7 toont gedeconvolueerde Ti2p en O1s XP-spectra voor gesynthetiseerde TiO2 monsters. De drie monsters vertoonden twee grote pieken bij 457,2 en 463,1 eV, wat overeenkomt met 2p 3/2 en 2p 1/2 van Ti 4+ in TiO2 [43]. Zeer vergelijkbare bindingsenergiewaarden werden waargenomen in Ti 2p regio voor alle drie TiO2 monsters die erop wezen dat de Ti-atomen in deze monsters in dezelfde oxidatietoestand bestonden. Twee kleine schouderpieken bij 455,8 en 458,7 eV werden ook waargenomen voor alle monsters. De schouder bij 455,8 eV kan worden toegewezen aan een Ti 3+ toestand, als gevolg van een zuurstoftekort in TiO2 [44], terwijl de andere schouderpiek bij 458,7 eV voortkomt uit een Ti 4+ toestand van de Ti-OH-soort [45]. Het is duidelijk uit de Ti2p spectra dat de bijdrage van zuurstofarm TiO2 soort is hoger in TiO2 -nit dan TiO2 -sul en TiO2 -aas monsters. Alle monsters toonden O1s XP piekt op 528,4, 529,3 en 531,3 eV. De XPS-piek van 528,4 eV kan worden toegeschreven aan O-Ti 4+ soorten in de TiO2 kristalrooster, terwijl andere twee pieken bij 529,3 en 531,3 eV kunnen worden toegewezen aan zuurstofsoorten die worden gepresenteerd in aan het oppervlak geadsorbeerde hydroxylgroepen [46].
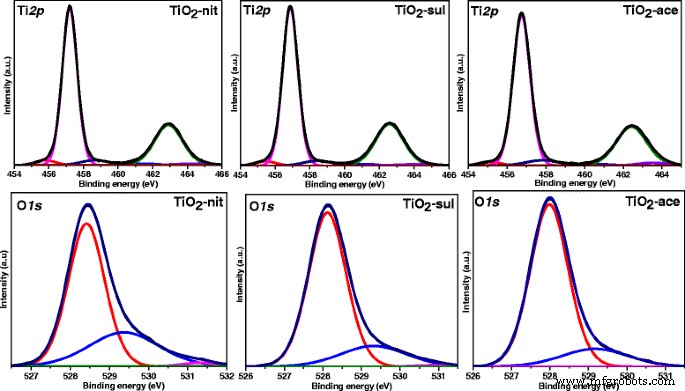
Ti 2p en O1s Röntgenfoto-elektronenspectra voor het gecalcineerde TiO2 voorbeelden
McCafferty [47] merkte ook op dat de O1s piek bezat een staartpiek bij de hoge bindingsenergiewaarden, wat te wijten zou kunnen zijn aan de aanwezigheid van Ti-OH-groepen. Aangezien het fysiek geadsorbeerde oppervlak, Ti-OH-groepen gemakkelijk kunnen worden verwijderd onder het ultrahoge vacuüm dat wordt gebruikt om het XPS-instrument te bedienen [48]. Deze -OH-groepen die in de monsters worden gepresenteerd, moeten het gevolg zijn van Ti-OH die chemisch is gebonden aan de oppervlaktedefecten van TiO2, waarbij de percentages van –OH-groepen in totale zuurstofsoorten voor TiO2 -nit-monster is iets hoger dan dat van TiO2 -sul en TiO2 -ace (tabel 2).
Fotokatalytische afbraak van kristalviolet, methyleenblauw en Para -nitro fenol kleurstoffen
De fotokatalytische activiteit van gecalcineerd TiO2 nanodeeltjes voor de afbraak van CV, MB en p -NP werd geschat. Er is gemeld dat de fotokatalytische afbraakreactie in het algemeen de kinetiek van Langmuir-Hinshelwood volgt [1]. Daarom kan de fotokatalytische afbraak van organische kleurstoffen worden uitgedrukt als
$$ -\mathrm{dc}/\mathrm{dt}=\mathrm{kC} $$ (5)en na de integratie, Vgl. (4) kan worden afgeleid
$$ C={C}_0{\exp}^{\left(-\mathrm{kt}\right)} $$ (6)waar C 0 is de beginconcentratie (ppm) van de organische kleurstoffen, en k is de snelheidsconstante, die afhangt van de reactietijd, temperatuur en de pH van de oplossing. Normaal gesproken neemt de fotokatalytische efficiëntie van de katalysator toe met de tijd dat deze in bedrijf is.
Er werden blanco experimenten uitgevoerd om het belang van zowel fotokatalysator- als UV-bestraling te bevestigen. Er vond geen reactie plaats wanneer de katalysator en de UV-bestraling alleen werden toegepast. Vergelijkbare resultaten werden waargenomen in onze eerdere bevindingen [49]. Zoals gemeld in het experimentele gedeelte, is de TiO2 fotokatalysatoren werden gedurende 45 minuten geëquilibreerd met de organische kleurstofoplossing om de adsorptie van organische kleurstoffen op gesynthetiseerd TiO2 te bepalen monsters. De UV-vis absorptiespectra van CV, MB en p -NP werden opgenomen na het in evenwicht brengen van de fotokatalysator. Aanvullend bestand 1:Afbeelding S2, S3 en S4 gaven de variatie in de UV-vis weer absorptiespectra van CV, MB en p -NP-oplossingen (10 ppm) met verschillende reactietijden over TiO2 -ace, TiO2 -sul en TiO2 -nit-monsters, respectievelijk. De intensiteit van absorptiepieken die overeenkomt met de CV, MB en p -NP nam af met de toename van de reactietijd. De UV-vis spectra van reactieproducten geven aan dat organische kleurstoffen werden afgebroken tijdens de fotoreactie. De TiO2 -nit-monster bleek de meest effectieve fotokatalysator te zijn in vergelijking met TiO2 -sul en TiO2 -aas monsters. Degradatie van 50% van p -NP werd binnen 60 min waargenomen voor de TiO2 -nit monster, terwijl 75 en 100 min nodig waren voor de afbraak van 50% p -NP voor de TiO2 -ace en TiO2 -sul monsters onder vergelijkbare omstandigheden. Vergelijkbare patronen van fotokatalytische activiteit werden waargenomen voor de afbraak van MB- en CV-kleurstoffen.
The percentage degradation efficiency of the investigated catalysts was calculated using Eq. (4). Figure 8 shows the percentage changes of CV, MB, and p -NP aqueous solution at room temperature in the presence of calcined TiO2 monsters. After just 10 min of the reaction, the TiO2 -nit sample showed 29% CV degradation efficiency, while TiO2 -ace and TiO2 -sul samples showed only 17 and 9%, respectively. The photocatalytic activity steeply increased with the increase of reaction time over the three samples. However, after 120 min, TiO2 -nit and TiO2 -ace samples showed 99% efficiency; however, TiO2 -sul sample showed only 65% efficiency.
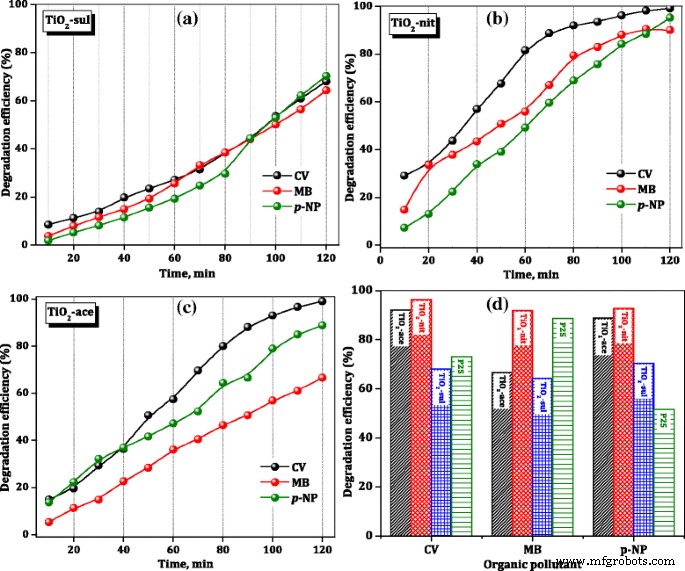
Photocatalytic degradation efficiency of TiO2 catalysts
To compare the photocatalytic performance of synthesized TiO2 samples, the degradation efficiency of the commercial P25 sample for organic dyes after 120 min is included in Fig. 8d. It is clear that TiO2 -nit sample showed better performance than the P25 sample in the degradation of three organic dyes; however, TiO2 -ace and TiO2 -sul samples showed lower activity than the P25 catalyst in case of p -NP degradation. These results are suggesting that the performance of catalysts is influenced by the physicochemical characteristics of the TiO2 samples and nature of the organic dye.
The rate constants for photocatalytic degradation of CV, MB, and p -NP over synthesized TiO2 samples and commercial P25 sample were determined from the slope of the straight line which is plotted between ln(C 0 /C t ) and t , and the results are presented in Table 3. The observed results are indicating that the photocatalytic activity of the degradation of organic dyes was greatly influenced by the composition of TiO2 sample and amount of the surface hydroxyl groups. The activity indeed is not influenced by the particle size, crystallinity, and surface area of TiO2 synthesized in this work. This observation is not consistent with the results observed by Fujishima et al. [8] that the catalyst which possesses lower particle size offered high photocatalytic efficiency.
Previously, it was reported that anatase is a better photocatalyst than rutile due to its high band gap energy and a large number of surface OH groups [50]. It was thought that TiO2 -nit sample would offer low photocatalytic activity due to the presence of more rutile phase (67%). However, Masahashi et al. [51] claimed that rutile exhibited higher performance than anatase MB degradation due to its superior crystalline nature.
Determination of photocurrent values was carried out to obtain a better insight responsible factor for the superior photocatalytic performance of the samples containing more rutile. It was reported that photocatalytic activity is directly related to the electron-hole separation efficiency of a catalyst which is influenced by the photocurrent density [52]. Theoretical photocurrent density of the TiO2 samples was calculated from the absorption edge of the TiO2 samples (obtained from DR UV-vis spectroscopy measurements) and theoretical equations (supporting information) presented in the literature [53]. The results of photocurrent of TiO2 samples are presented in Table 4 along with the percentage of rutile and photocatalytic efficiency values. The photocurrent density of TiO2 -nit (0.545 mA/cm 2 ) is higher than other two synthesized TiO2 samples and also commercial P25 sample (0.401 mA/cm 2 ), manifesting the beneficial role of rutile phase in improving the photoactivity of TiO2 voorbeelden.
Previously, Melcher et al. [54] reported that photocatalytic capability of the commercial P25 material originates due to the presence of a mixture of rutile and anatase phases in the sample (75% anatase and 25% rutile). Hirakawa et al. [55] indicated that pure rutile itself is not a powerful photocatalyst, and it is also reported that the light with a wavelength of 380 nm is not powerful enough to generate charge carriers in the pure anatase [56]. Based on XPS spectroscopy results and theoretical calculations, Scanlon et al. [57] concluded that electrons were moved from rutile to anatase and the holes were transported from anatase to rutile, which inhibited the electron-hole recombination. Yu et al. [58] reported a similar observation that TiO2 sample with mixed phases was beneficial to decrease the rate of h + -e − recombination and thus enhance the photocatalytic efficiency of the catalyst.
In literature reports, two possible transfer mechanisms have been proposed for anatase-rutile composite samples [59]. The first mechanism is the interfacial electron transfer from CB of anatase to that of the rutile [60], and the second one is an electron transfer from CB of rutile to lower energy anatase active sites [61]. It is known that the anatase CB possesses higher negative potential than the rutile CB due to the fact that anatase has a higher band gap (3.12 eV) than rutile. Therefore, it is not possible for an electron to move from the rutile CB to the anatase CB because it would have to overcome the energetic barrier between the two bands. The band gap of anatase VB is also slightly higher, than the rutile VB, so the generated holes could be moved to the anatase VB, to achieve an effective charge separation. Most probably, the electron-hole pair is formed in the composite of rutile and anatase in case of TiO2 -nit and TiO2 -sul samples (Fig. 9), and this rate is much higher in TiO2 -nit sample due to predominant rutile formation.
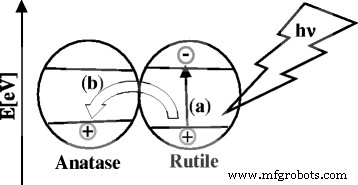
Plausible model of a generation of electron-hole pairs and b effective charge carrier separation via transfer of the generated holes into the anatase valence band
It was reported that increase of crystal growth of initial phase is possible by increasing the mobility of ions presented in precursor solution [62]. Several researchers added small volumes of mineral acids (such as hydrochloric acid and sulfuric acid) to improve the mobility of dissociated ions [63]. Their role is not only to increase the rate of diffusion of ions in a solution but also to alter the surface charge. Under humidity conditions, titanium isopropoxide can subsequently undergo hydroxylation and polymerization to TiO2 .
$$ \mathrm{Ti}{\left(\mathrm{OPri}\right)}_4+4{\mathrm{H}}_2\mathrm{O}\to \mathrm{Ti}{\left(\mathrm{OH}\right)}_4+4\ \mathrm{PriOH}\kern2.5em \left(\mathrm{hydroxylation}\right) $$ (7) $$ \mathrm{Ti}{\left(\mathrm{OH}\right)}_{4\kern0.5em }\to {\mathrm{TiO}}_{2.}x{\mathrm{H}}_2\mathrm{O}+\left(2\hbox{-} x\right)\ {\mathrm{H}}_2\mathrm{O}\kern5em \left(\mathrm{condensation}\right) $$ (8)Depending on the nature of peptizing acid, the transformation of TiO2 leads to anatase or rutile phase [64]. Formation of amorphous TiO2 or metastable anatase phase was observed when the condensation initiated before hydrolysis of Ti precursor. Under highly acidic conditions, the rutile phase formation is favorable as the rate of condensation is slow. Accordingly, the rutile phase was obtained when sulfuric and nitric acids were used for the peptization. The use of weak acid (acetic acid) as a peptizing agent allows the control of both the degree of condensation and oligomerization and persuades the preferential crystallization of TiO2 in the anatase phase. Zeng et al. [20] used polycarboxylic acid as a peptizing agent and observed the formation of nanoparticles of anatase which they attributed to chelation effect of organic acid.
It is known that TiO6 octahedra are a fundamental structural unit for both anatase and rutile phases (D 4h system), and the only difference between these two structures is the assembly of the octahedral chains [65]. Face-shared linking of TiO6 units results in anatase structure, while edge-shared linking results in rutile structure [66]. It is clear that NO 3− anions possessed weaker affinity to Ti atoms in an aqueous solution than CH3 COO − and SO4 2− anions. The strong affinity of CH3 COO − and SO4 2− anions with Ti atoms is responsible for the inhibition of the phase transformation.
In the previously reported studies, many of the photocatalysts have not been tested for reuse mainly due to undergo photocorrosion; hence, their photostability is reduced for further usage. The reusability of the calcined TiO2 samples was examined to study the effectiveness of these photocatalysts. It was observed that the used photocatalyst offered 90% efficiency for three consecutive cycles. The efficiency of the catalyst was reduced to 80 and 75% during fourth and fifth cycle, respectively. The decrease is due to the loss of some amount of catalyst during the filtration and regeneration procedures.
Conclusies
A simple peptization method was adapted to synthesize TiO2 nanoparticles by using sulfuric, nitric, and acetic acid as peptizing agents and titanium isopropoxide as Ti precursor. The influence of acid species on the crystal phase, morphology, textural, and surface composition of TiO2 were studied in detail. De TiO2 sample peptized with acetic acid possessed pure anatase phase, while the formation of minor (5%) and major (67%) of rutile phase was observed in case of samples peptized with sulfuric acid and nitric acid, respectively. It is observed that TiO2 peptized with nitric acid showed sheet-like structures along with nanoparticles, while TiO2 samples peptized with sulfuric and acetic acids possessed near spherical nanoparticles. The photocatalytic properties of synthesized TiO2 nanostructures were evaluated for photodegradation of aqueous CV, MB, and p -NP solutions. De TiO2 peptized using nitric acid showed the best photocatalytic activity than commercial P25 and other two peptized samples, and its photodegradation efficiency was reached to 95% in 120 min for p -NP degradation. Although TiO2 samples peptized using sulfuric acid and acetic acid possessed smaller particle size, higher band gap energy, and high surface area, TiO2 sample peptized with nitric acid possessed a higher percentage of rutile and photocurrent density. The observed photocurrent density is dominated by the photoactivity of TiO2 . The results indicate a direct correlation between the photocatalytic activity and the photocurrent density of the TiO2 monsters. The superior activity of TiO2 sample peptized with nitric acid is due to the effective transfer of photogenerated electrons between rutile and anatase phases, and large pore diameter could have enhanced the diffusion and mass transportation of reacting molecules and OH radicals during the photochemical reaction. De gesynthetiseerde TiO2 photocatalysts can be recycled with a minor change in the activity.
Afkortingen
- CV:
-
Crystal violet
- DR UV-vis :
-
Diffuse-reflectance ultraviolet-visible spectroscopy
- FTIR:
-
Fourier-transformatie infraroodspectroscopie
- HRTEM:
-
Transmissie-elektronenmicroscopie met hoge resolutie
- MB:
-
Methylene blue
- NMR:
-
Nuclear magnetic resonance
- p –NP:
-
para –nitro phenol
- TEM:
-
Transmissie-elektronenmicroscopie
- TiO2 :
-
Titanium oxide
- XPS:
-
Röntgenfoto-elektronenspectroscopie
- XRD:
-
Röntgenpoederdiffractie
Nanomaterialen
- Eenstaps elektrospinning-route van SrTiO3-gemodificeerde Rutiel TiO2nanovezels en zijn fotokatalytische eigenschappen
- Hoge fotokatalytische prestaties van twee soorten grafeen-gemodificeerde TiO2-composietfotokatalysatoren
- Nanodeeltjes als effluxpomp en biofilmremmer om het bacteriedodende effect van conventionele antibiotica te verjongen
- Op weg naar TiO2-nanovloeistoffen - Deel 2:Toepassingen en uitdagingen
- Effect van gouden nanodeeltjesdistributie in TiO2 op de optische en elektrische kenmerken van kleurstofgevoelige zonnecellen
- De effecten van Li/Nb-verhouding op de voorbereiding en fotokatalytische prestaties van Li-Nb-O-verbindingen
- Fotokatalytische activiteiten verbeterd door Au-plasmonische nanodeeltjes op TiO2-nanobuisjesfoto-elektrode gecoat met MoO3
- Voorbereiding en fotokatalytische prestaties van LiNb3O8-fotokatalysatoren met holle structuur
- Structurele en zichtbare infrarood optische eigenschappen van Cr-gedoteerde TiO2 voor gekleurde koele pigmenten
- TiO2-nanobuisarrays:gefabriceerd op basis van een zacht-hard sjabloon en de korrelgrootte-afhankelijkheid van veldemissieprestaties
- Bepaling van de katalytische activiteit van met overgangsmetaal gedoteerde TiO2-nanodeeltjes met behulp van oppervlaktespectroscopische analyse



