Synthese en CO-oxidatieactiviteit van 1D gemengd binair oxide CeO2-LaO x ondersteunde gouden katalysatoren
Abstract
Eendimensionale (1D) Ce-La-nanostaafjes met verschillende La-gehalten (Ce en La in de molaire verhouding van 1:0, 3:1, 1:1, 1:3 en 0:1) werden gesynthetiseerd door een hydrothermisch proces. Au/Ce-La nanorod-katalysatoren werden verkregen door een gemodificeerde depositie-precipitatiemethode. De monsters werden gekenmerkt door N2 adsorptie-desorptie (BET), ICP, röntgendiffractie (XRD), SEM, TEM, EDX, röntgenfoto-elektronspectroscopie (XPS), UV-vis diffuse reflectiespectroscopie (UV-vis DRS) en temperatuurgeprogrammeerde reductie (H2 -TPR). Het onthulde dat La bestond als LaO x in de 1D nanostaafjes. De katalyseresultaten toonden aan dat de gemengde binaire Ce-La-nanostaafoxiden een goede ondersteuning zouden kunnen zijn voor goudkatalysatoren. De inhoud van La had een belangrijke invloed op de katalytische prestatie van Au/Ce-La nanorod-katalysatoren. Van de katalysatoren, wanneer de Ce/La molaire verhouding 3:1 was, was de 1,0%Au/Ce0,75 -La0,25 nanostaafjes voorbehandeld bij 300 ° C vertoonden de beste activiteit onder de katalysatoren voor CO-oxidatie, die CO volledig kon omzetten bij 30 ° C. De katalysatoren waren ook bestand tegen hoge temperaturen en een goede stabiliteit voor CO-oxidatie bij de reactietemperaturen van 40, 70 en 200 °C.
Achtergrond
Als een zeer schadelijk gas kan CO sterk binden aan het ijzeratoom in hemoglobine in het bloed, waardoor het vrijkomen van zuurstof wordt voorkomen. Zijn aanwezigheid binnenshuis kan dus in korte tijd zelfs de dood van mens en dier veroorzaken. Het is een steeds groter probleem geworden op het gebied van luchtvervuiling. Katalytische CO-oxidatie is een van de meest effectieve oplossingen voor CO-verwijdering om een dergelijk ernstig milieuprobleem op te lossen [1,2,3,4,5,6,7,8]. Het heeft de laatste tijd ook veel aandacht gekregen van de wetenschappelijke gemeenschap op het gebied van apparaten voor verontreinigingsbeheersing voor de zuivering van uitlaatgassen van voertuigen, reiniging van de binnenlucht en lage-temperatuur-CO-sensoren [6,7,8,9,10]. In veel gevallen verspreidde het kostbare Au zich op specifieke metaaloxiden met een hoge zuurstofopslagcapaciteit zoals CeO2 , TiO2 , en Fe2 O3 zijn zeer effectieve kandidaten voor de CO-oxidatie [11,12,13]. In de afgelopen decennia hebben onderzoeken naar de gedragen goudkatalysatoren voor CO-oxidatie bij lage temperaturen geleid tot onverwachte waarnemingen. Het is algemeen aanvaard dat de katalytische activiteiten van Au-katalysatoren sterk afhangen van de aard van Au-nanodeeltjes en eigenschappen van de dragers, zoals de gouddeeltjesgrootte, de Au-metaal-dragerinteractie en de reduceerbaarheid van de drager [14,15,16 ,17,18].
Als een van de belangrijkste zeldzame aardoxiden, CeO2 is op grote schaal gebruikt in driewegkatalysatoren als een efficiënte katalysatordrager vanwege zijn unieke fysische en chemische eigenschappen [6, 8, 15, 17]. CeO2 heeft een uitstekende zuurstofopslag en -afgifte door de mogelijkheid om Ce 4+ . te schakelen /Ce 3+ , waardoor CeO2 worden een actieve oxidecomponent van verschillende oxidatiekatalysatoren die worden gebruikt in diverse redox-katalytische reacties [17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32]. Oppervlakken, mesoporeuze structuren, roosterdefecten en synergetische effecten met andere doteermiddelen kunnen allemaal de katalytische eigenschappen van ceria-nanomaterialen bevorderen [3, 22]. Om de prestaties van Au-CeO2 verder te verbeteren katalysatoren voor CO-oxidatiereactie, zijn er veel strategieën uitgeprobeerd, zoals bereidingsmethoden, waaronder depositie-precipitatie, coprecipitatie en ureum-gelering coprecipitatie, die is gebruikt om de interactie van de Au-O-Ce-structuur te regelen en te optimaliseren, evenals als de grootte en vorm van ceria [33,34,35]. Er zijn ook pogingen ondernomen door de oppervlaktemodificatie van de drager [4, 5, 22, 24, 26, 36,37,38]. Gebleken is dat het gebruik van binaire gemengde oxiden als drager een goede oplossing zou kunnen bieden voor de stabilisatie van gouden nanodeeltjes. Bovendien verbetert de bevordering door edel- of overgangsmetaal de reduceerbaarheid van ceria en vergemakkelijkt het de vorming van zuurstofvacatures aan het oppervlak. Ondertussen is bewezen dat doping met overgangsmetaalkationen een effectieve methode is om de fysisch-chemische eigenschappen van eendimensionale (1D) nanogestructureerde nanomaterialen, zoals katalytische activiteit, te bevorderen [38,39,40]. Wang et al. [5] wijzigde het oppervlak van Au/CeO2 met sterk verspreide CoO x en vertoonden uitstekende katalytische activiteit bij lage temperatuur CO-oxidatie. Ma et al. [37] meldde dat CaO, NiO, ZnO, Ga2 O3 , Y2 O3 , ZrO2 , en zeldzame-aarde-additieven aan de goud-titania-katalysator zijn gunstig voor de CO-oxidatie, en de gedoteerde katalysatoren kunnen een significante activiteit vertonen bij omgevingstemperatuur na veroudering bij 500 °C. Park et al. [38] meldde dat CeO x gewijzigde TiO2 drager is een goede katalysator voor watergasverschuivingsreactie. Er is veel onderzoek gedaan naar gemengde metaaloxiden voor de katalytische oxidatie van CO. Deze gedoteerde metaalionen worden ofwel afgezet op het oppervlak van de drager in de vorm van oxidedeeltjes of in een rooster van de drager, die geen afzonderlijke oxidefase zou kunnen vormen. Het doel van dit onderzoek is om 1D binaire Ce-La nanostaafjes te maken, dit is een niet-perovskiet of gemengd oxide van het vaste oplossingstype. Dat wil zeggen, in de 1D-nanostaafstructuur bestaan de twee metaaloxiden naast elkaar en combineren ze de verdiensten van de twee samenstellingen om het synergetische effect te maximaliseren. Vanwege potentiële technologische toepassingen zijn de afgelopen jaren veel 1D-nanomaterialen, waaronder nanostaafjes, nanodraden en nanobuisjes, uitgebreid onderzocht [2, 4, 41, 42]. Deze 1D-nanogestructureerde materialen, met name 1D-nanostaafmaterialen, zijn bestudeerd als belangrijke dragers of actieve componenten op het gebied van katalyse, optica en elektrochemie, zoals goed gecontroleerde siliciumnanodraden die in zonnecellen worden gebruikt [42]. Het is gebleken dat de eigenschappen van materialen met 1D-structuur, zoals katalytische activiteit, vaak nauw verband houden met hun kristalstructuur en vorm. Als gevolg hiervan blijkt de ontwikkeling van 1D-nanostaafjesmaterialen om hun elektronische en katalytische eigenschappen aan te passen intrigerend en waardevol te zijn.
Hierin rapporteren we een eenvoudige solvothermische strategie om een reeks gemengde Ce-La nanorod-composieten te bereiden. In het syntheseproces wordt de LaO x en CeO2 samen kunnen groeien in één staaf. De morfologie van de eindproducten werd niet beïnvloed. De XRD- en TEM-resultaten laten zien dat de La-kationen hebben bestaan in de vorm van LaO x . Er werd gevonden dat de doteerstof van LaO x toonde een positief effect op de activiteit van goud-ceriumkatalysatoren. Au/Ce0,25 -La0.75 nanostaafjes vertoonden uitstekende katalytische activiteit voor CO-oxidatie.
Experimenteel
Alle chemicaliën in dit artikel waren van analytische kwaliteit en werden zonder enige zuivering gebruikt zoals ze waren ontvangen.
Ondersteuning voorbereiden
De Ce-La nanostaafjes werden gesynthetiseerd door de conventionele hydrothermische methode. In een typische synthese worden oplossingen van NaOH (9 mol/L) en Ln(NO3 )3 (Ln =Ce, La, 0,8 mol / L) werden gemengd en gedurende 30 minuten krachtig geroerd bij kamertemperatuur. De resulterende suspensie werd in een met Teflon beklede roestvrijstalen autoclaaf gegoten. De autoclaaf werd afgesloten en 14 uur op 110°C gehouden en vervolgens aan de lucht afgekoeld tot kamertemperatuur. De resulterende producten werden gefilterd, gewassen met gedeïoniseerd water en absolute alcohol, 12 uur gedroogd bij 80 °C en vervolgens gecalcineerd bij 400 °C in lucht met een verwarmingssnelheid van 5 °C min −1 voordat ze gouden nanodeeltjes ondersteunen. De eindproducten met verschillende La-gehalten (Ce en La in de molaire verhouding van 1:0, 3:1, 1:1, 1:3 en 0:1) werden aangeduid als Ce nanostaafjes, Ce0.75 -La0,25 nanostaafjes, Ce0,50 -La0,50 nanostaafjes, Ce0,25 -La0.75 nanostaafjes en La nanostaafjes.
Voorbereiding katalysator
Een depositie-precipitatieproces werd uitgevoerd om Au/Ce-La nanorod-katalysatoren te bereiden. In het kort, de benodigde hoeveelheid Ce-La-nanostaafjes werd gedispergeerd in 100 ml gedeïoniseerd water en vervolgens gemengd met een bepaalde hoeveelheid 0,01 mol/L HAuCl4 oplossing. Als de pH van de uiteindelijke HAuCl4 oplossing was ongeveer 7, wat verband hield met de basiciteit van de drager en de zuurgraad van HAuCl4 , zou de pH van de oplossing niet worden aangepast. De suspensie bleef 12 uur roeren en werd 4 uur onder terugvloeikoeling gekookt bij 100°C. Na de afzetting-precipitatieprocedure werd het precipitaat gecentrifugeerd, gewassen met water om Cl − te verwijderen ionen en gedurende 12 uur onder lucht bij 80 ° C gedroogd. De concentraties van goud werden uitgedrukt als massapercentage.
Karakterisatietechnieken
Goudladingen van Au / Ce-La nanorod-katalysatoren werden bepaald door inductief gekoppelde plasma-atomaire emissiespectroscopie (ICP-9000, VS Thermo Jarrell-Ash Corp). De Brunauer-Emmett-Teller (BET) oppervlakten van Ce-La nanorod-monsters werden gemeten door stikstofadsorptie bij -196 ° C met behulp van een Micromeritics Tristar II 3020-apparaat. Het XRD-onderzoek is uitgevoerd op een Rigaku D/Max-2500 röntgendiffractometer (Kα λ = 0.154 nm) in de 2θ bereik van 3-80°. Uv-zichtbare DRS van de katalysatoren werd verzameld op een UV-vis NIR-spectrofotometer (JASCO Corp V-570). TEM-waarnemingen en energiedispersieve röntgenanalyse (EDX) werden verkregen met een JEM-2100 transmissie-elektronenmicroscoop die werkte bij 200 kV. SEM-gegevens en afbeeldingen van elementmapping werden verkregen met een JSM-7500F scanning-elektronenmicroscoop die werkte bij 15 kV. XPS werden opgenomen om de chemische samenstelling en de oxidatietoestand van de katalysatoren te identificeren op een Kratos Axis Ultra DLD röntgenfoto-elektronspectrometer met behulp van een monochromatisch Al Kα bron werkte op 150 W. De bindingsenergieën werden gekalibreerd met behulp van de C 1s piek gelegen op 284,6 eV. Temperatuurgeprogrammeerde verlaging (H2 –TPR) werd uitgevoerd op een PX200-apparaat om H2 . te meten consumptie. Voorafgaand aan H2 -TPR-analyse, de monsters werden gedurende 1 uur bij 300 ° C voorbehandeld in He-flow. Na afkoeling tot 50°C werd de katalysator gereduceerd met 10 vol% H2 /Ar gasstroom door verwarming tot 900 °C met een snelheid van 10 °C/min.
Katalytische activiteitstest
Evaluatie van de katalytische activiteit werd uitgevoerd in een millireactor met vast bed met een binnendiameter van 8 mm. Voorafgaand aan de reactie werd 200 mg katalysator verdund met 17,6 g chemisch inert kwartszand. Vervolgens werd een mengsel, 10% CO gebalanceerd met lucht, in de reactor gebracht met een totale stroomsnelheid van 36,3 ml min −1 . Na 30 min op de reactietemperatuur te hebben gehouden, werden de gasvormige producten online geanalyseerd door CO x analysator (GC-508A gaschromatografie). CO-conversie werd berekend volgens de volgende vergelijking:
$$ \mathrm{CO}\kern0.5em \mathrm{conversion}=\frac{\left[\mathrm{CO}\ 2\right]}{\left[\mathrm{CO}\right]+\left[ \mathrm{CO}\ 2\right]}\times 100\% $$waarbij [CO] en [CO2 ] vertegenwoordigen de uitlaat CO en CO2 respectievelijk concentratie. De temperatuurafhankelijkheid van de katalytische activiteit van het monster werd geregistreerd in het bereik van 30-200 °C met een hellingssnelheid van 10 °C min −1 .
Resultaten en discussie
Karakterisatie van Au/Ce-La Nanorod-katalysatoren
ICP
De hoeveelheden goud die aanwezig zijn in Au/Ce-La nanorod-katalysatoren werden bepaald door ICP-AES. De in tabel 1 getoonde resultaten lieten zien dat de werkelijke hoeveelheid goud in alle katalysatoren lager was dan de nominale. Volgens de voorbereidingsprocedure zou goud verloren moeten gaan tijdens het depositie-precipitatieproces.
BET
N2 absorptiemetingen werden gebruikt om het BET-oppervlak en de gemiddelde diameter te meten op beide CeO2 nanostaafjes en Ce-La nanocomposieten. Zoals getoond in Fig. 1 waren de adsorptie-isothermen voor de Ce-La-nanostaafjes van type IV en vertoonden ze kenmerken van H3-hysteresislussen. Alle monsters laten een zeer sterke stijging zien van N2 -geadsorbeerd volume bij een relatieve druk groter dan 0,85, wat een kenmerk is van de aanwezigheid van een aanzienlijke hoeveelheid mesoporeuze, [2, 22], wat wijst op Ce-La-nanocomposieten bestaande uit aggregaten (losse assemblages) die spleetachtige poriën vormen. Met de dotering van La verschoven hysteresislussen naar een relatieve druk van ongeveer 0,95, wat betekende dat de poriën kleiner zouden worden, wat overeenkomt met de afname van Ce-La-composieten. Zoals weergegeven in tabel 2, specifiek oppervlak van CeO2 nanostaafjes is 99,7 m 2 /g, wat afneemt tot 74,1 m 2 /g wanneer La is gedoteerd met de Ce/La molaire verhouding van 3:1. Met een toenemend La-gehalte nam het oppervlak van Ce-La-nanocomposieten continu af. Dit komt voornamelijk door de inhoud van La, die niet zou worden ingebed in het rooster van CeO2 en bestaan als geïsoleerde LaO x wat leidt tot weinig verschil in morfologie van Ce-La-nanocomposieten. Het kan worden waargenomen dat alle nanostaafjes vergelijkbare oppervlakten hebben van 80–100 m 2 /G. Poriënvolume van Ce0,75 -La0,25 nanostaafjes is 0,23 cm 3 /g, die vergelijkbaar was met die van Ce-nanostaafjes, en groter dan andere Ce-La-nanostaafjes. De geschatte poriediameters van BJH-analyse bevestigden de mesoporeuze aard van Ce-La-nanocomposieten. Het is misschien wel het voordeel voor de katalytische CO-oxidatie.
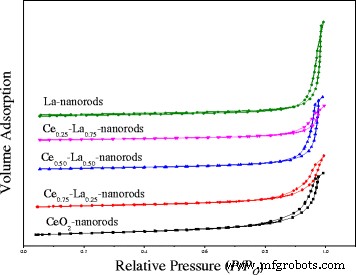
Stikstofadsorptie-desorptie-isothermen van Ce-La-nanostaafjes met verschillende La-inhoud
XRD
De gesynthetiseerde monsters werden onderworpen aan poederröntgendiffractieanalyse en hun structurele eigenschappen werden vervolgens geanalyseerd. De kristalliniteitspieken voor ceriumoxide (Fig. 2a) werden waargenomen bij 2θ =28,6 °, 33,1 °, 47,6 ° en 56,3 ° overeenkomend met de (111), (200), (220) en (311) diffractievlakken en bevestigen de kubische fluorietstructuur van CeO2 kristal (JCPDS nr. 34-0394). Wanneer het gehalte aan La 0,25 at.% was, werden de diffractiepieken van de La-Ce-composieten breder. Pieken gecentreerd op 2θ = 30,0°, 46,0°, 52,0° en 53,6° komen overeen met diffractievlakken van de geïsoleerde La2 O3 . Geen pieken toegewezen aan La(OH)3 kon worden gedetecteerd. Maar vanwege het lage gehalte en de geschatte diffractiepositie is het niet eenvoudig om het bestaan van LaO x vast te stellen. . Bij toenemend La-gehalte worden enkele prominente pieken waargenomen voor La2 O3 of La(OH)3 in het nanocomposiet. De belangrijkste diffractiepieken van La2 O3 zijn aanwezig op 2θ = 30,0° (101), 39,6° (220), 46,2° (110) en 66,8° (112), die kunnen worden toegewezen aan de zeshoekige fase (JCPDS-kaart 05-0602). De belangrijkste diffractiepieken van La(OH)3 zijn aanwezig op 2θ = 15,7° (100), 27,3° (110), 27,9° (101) en 39,4° (201), die kunnen worden toegewezen aan de hexagonale fase (JCPDS-kaart 36-1481). De resultaten tonen aan dat La zou kunnen bestaan als geïsoleerde La2 O3 of La(OH)3 in de composiet. Na de afzetting van goud was er geen diffractiepiek die kon worden geïndexeerd met de zuivere kristallijne structuur van goud in het midden van het gezicht (figuur 2b). Dit kan te wijten zijn aan het lage gehalte en/of de kleine deeltjesgrootte van gouden nanodeeltjes.
XRD-patronen van 1% Au/Ce-La nanostaafjes met verschillende La-gehalten (0-100 at.%) (a ) en Au/Ce0,75 -La0,25 nanostaafjes met verschillende Au-ladingen gecalcineerd bij 300 °C gedurende 2 uur (b )
SEM en TEM
Afbeelding 3a–e toont de SEM-foto's van de CeO2 en Ce-La nanocomposieten verkregen in verschillende concentraties van La 3+ ionen. Het is te zien dat alle Ce-La-nanocomposieten een staafvormige structuur vertoonden. Het is duidelijk dat veel staafjes zich opstapelden tot Ce-La-bundels, wat leidde tot de vorming van spleetachtige poriën met verschillende groottes. De resultaten waren in overeenstemming met de N2 adsorptie-desorptie isothermen. Zoals weergegeven in figuur 2a, bestaat het product voornamelijk uit nanostaafjes met een diameter van 5-10 nm en een lengte van 100-300 nm. In figuur 3e was duidelijk een grote hoeveelheid nanostaafjes met een diameter van ongeveer 12,5 nm te zien, en er waren ook een kleine hoeveelheid korte nanostaafjes met een gemiddelde diameter van ongeveer 8,0 nm. In Fig. 3b-d, met toenemende dopingconcentratie van La 3+ , vertonen de monsters altijd nanorod-morfologie. Hoewel de dopingconcentratie 25 mol% was, vertoonden de verkregen monsters de meest uniforme nanostaafjes met een diameter van 5-20 nm en een lengte van 100-300 nm van alle monsters. Figuur 3f toont TEM-afbeeldingen van de verkregen individuele Ce-La-nanostaafjes. Men kon zien dat er veel poriën in de drager zijn, zoals blijkt uit de stikstofadsorptie-desorptie-isothermen. Het HRTEM-beeld van de Ce-La-nanostaafjes onthulde dat ze structureel uniform en enkelkristallijn van aard zijn. De roosterranden in figuur 3f illustreren twee interplanaire afstandswaarden, d.w.z. 0,31 en 0,34 nm, die consistent zijn met de (111), (110) vlakken van de CeO2 en La2 O3 , respectievelijk [3, 15, 43]. Het bleek dat de La 3+ ionen zijn effectief gegenereerd in La2 O3 , wat consistent is met het XRD-spectrum.

SEM-afbeeldingen van Ce-La-nanostaafjes met verschillende La-gehalten:0 (a ), 25 at.% (b ), 50 at.% (c ), 75 at.% (d ), 100 at.% (e ); TEM-afbeelding van Ce0,50 -La0,50 nanostaafjes (f ); en de inzet toont de bijbehorende HRTEM-afbeelding
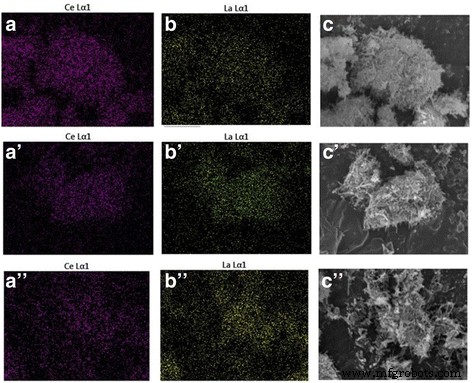
Element mapping en EDS-analyse werden gebruikt om de chemische samenstelling van Ce-La-monsters te bepalen (Fig. 4 en Tabel 3). De resultaten toonden uniforme La/Ce-molverhoudingen in goede overeenstemming met de verwachte waarden van de synthese. De TEM-afbeeldingen van Au/Ce0,75 -La0,25 monsters gecalcineerd bij 300 ° C (figuur 5a) en 400 ° C (figuur 5c) toonden duidelijk aan dat de vormen van de Ce-La-nanokristallen in wezen onveranderd waren na toevoeging van goud. Er werden geen gouddeeltjes waargenomen door TEM op de Ce-La nanostaafjes. De aanwezigheid van zeer sterk verspreide goudclusters (d <1 nm) is aangetoond door elementmapping en EDX-analyse (inzet in Fig. 5b, e en f). In overeenstemming, XRD-analyse uitgevoerd op dit monster (Fig. 2) onthulde geen pieken gerelateerd aan goud vanwege het feit dat de gouddeeltjes te klein zijn om te worden gedetecteerd. Dit geeft aan dat de Ce-La nanorod-oppervlakken goudatomen kunnen verspreiden en stabiliseren als sub-nanometerclusters (TEM onzichtbaar). Dit is in overeenstemming met de literatuur [2, 44,45,46]. Sommige grote agglomeraten van gouddeeltjes (gemiddeld d ~ 7 nm) zijn waargenomen in Au/Ce0,75 -La0,25 nanostaafjes gecalcineerd bij 400 ° C vanwege de franjes met een tussenruimte van 0,236 nm die zijn toegewezen aan het (1 1 1) vlak van metallisch Au (Fig. 5c waarin een agglomeraat van gouddeeltjes wordt getoond). Het was te zien dat, samen met de hoge calcineringstemperatuur, er duidelijk gouddeeltjes groeiden, wat leidde tot het verlies van katalytische activiteit.

De elementafbeeldingen van Ce en La, SEM-afbeeldingen van de gemengde monsters voor Ce-La-nanostaafjes met La-gehalten van 25 at.% (a –c ), 50 at.% (a ′–c ′), 75 aan.% (a ′′–c ″)
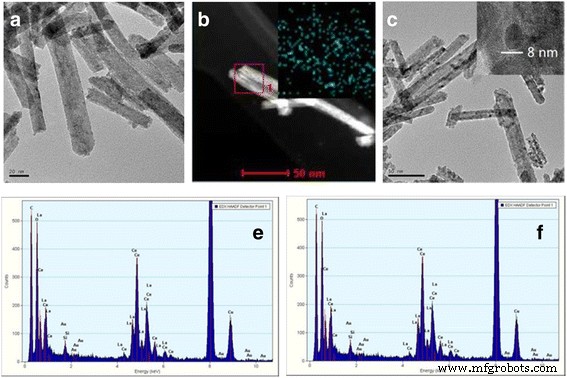
TEM- en STEM-beelden van 0,5% Au/Ce0,75 -La0,25 nanostaafjes gecalcineerd bij 300 °C (a –b ) en 400 °C (c ), EDX-analyse (e –f ) van de afbeeldingen van (a –b ) die de aanwezigheid van een Au-signaal aangeeft
XPS
De XPS-spectra in Fig. 6 zijn uitgevoerd om de chemische samenstelling en toestanden in 1%Au/Ce0,75 te onderzoeken. -La0,25 nanostaafjes gecalcineerd bij 300 ° C gedurende 2 uur. Het XPS-spectrum van Ce 3d toont de duidelijke pieken van 3d 3/2 spin-baan toestanden en 3d 5/2 spin-baan toestanden in figuur 6a. Zoals bekend, bevinden de pieken zich bij een bindingsenergie van ongeveer 899, 903 en 916 eV die normaal gesproken wordt gebruikt als de spectroscopische marker om de aanwezigheid van Ce 4+ te detecteren. staat. In ons geval, Ce 3d kernniveaus tonen drie spin-orbitale doubletten, de karakteristieke pieken voor de tetravalente toestanden van Ce 4+ . De pieken rond 882,8, 888,1 en 898,4 eV worden toegewezen aan de Ce 3d 5/2 , en die rond 901.3, 907.0 en 916.7 eV worden toegewezen aan de Ce 3d 3/2 , overeenkomend met spin-baan gesplitste doubletten van Ce (IV) verbindingen. De waargenomen resultaten komen overeen met gerapporteerde literatuur in het algemeen [19, 28, 29, 32]. Het is duidelijk dat de monsters zich in de staat Ce 4+ . bevinden zonder enige onzuiverheid van de Ce 3+ staat. Figuur 6b toont de XPS-spectra van de La 3d regio van 1%Au/Ce0,75 -La0,25 nanostaafjes. Zowel de spin-baan split 3d 5/2 en 3d 3/2 niveaus vertoonden dubbele piekstructuren. De spin-baan splitsing tussen de 3d 3/2 en 3d 5/2 niveaus was ongeveer 17,0 eV en de scheiding tussen de satelliet en de hoofdpiek was 4,1 eV, wat overeenkwam met de gerapporteerde waarden voor La 3+ verbindingen [11, 47]. Zoals te verwachten is, komt La uit in de + 3 oxidatietoestand en kan het een belangrijke invloed hebben op de katalytische activiteit. De O 1s XPS-spectrum (Fig. 6c) is asymmetrisch en gedeconvolueerd in respectievelijk 529,3, 531,6 en 527,6 eV. De piek bij 529,3 eV wordt toegewezen aan roosterzuurstof en die bij ongeveer 531,9 eV wordt toegewezen aan hydroxylgroepen op het oppervlak van de drager [27, 28, 32]. De kleine schouderpiek bij 527,6 eV wordt toegeschreven aan La-O, wat ook de aanwezigheid van LaO x zou kunnen onthullen in de katalysatoren [11, 48]. Er zijn duidelijk grote aantallen hydroxylgroepen op het oppervlak van de drager volgens de hoge piekintensiteit. De XPS-spectra in de Au 4f gebied van de katalysatoren gecalcineerd bij 300 en 400 ° C worden getoond in Fig. 6d. In Fig. 6d vertoonden de katalysatoren die bij 300 °C waren gecalcineerd de Au 4f 7/2 bindingsenergiesignalen bij 84,6 eV. De signalen waren kenmerkend voor kationische Au + soorten [14, 15, 31]. Ter vergelijking:nadat de katalysatoren waren gecalcineerd bij 400 ° C, de Au 4f 7/2 piek bevond zich bij bindingsenergie van 83,6 eV, en Au 4f 5/2 bevond zich op een bindingsenergie van 87,7 eV. De aanwezigheid van metalen Au 0 duidelijk wordt waargenomen. De kleine pieken rond 85,0 en 88,2 eV, overeenkomend met geoxideerde goudsoorten, werden ook gedetecteerd. Het is duidelijk dat de bij 300 °C gecalcineerde katalysatoren praktisch voornamelijk kationische Au + vertoonden soorten (> 90% van Au + soorten). Daarentegen hebben de bij 400 °C gecalcineerde monsters 90% Au 0 en 10% van Au δ+ . De overdracht van elektronendichtheid van metallisch Au naar de drager resulteerde in de gedeeltelijke oxidatie van Au en een sterke interactie tussen goud en drager. De aanwezigheid van Au δ+ is verantwoordelijk voor de gedeeltelijke vermindering van het steunoppervlak. Dienovereenkomstig, Au δ+ wordt als actiever beschouwd dan Au 0 voor CO-oxidatie [11, 21]. In ons geval hadden de katalysatoren die bij 300 °C waren gecalcineerd meer Au δ+ dan die gecalcineerd bij 400 °C, dus het is niet moeilijk om af te leiden dat de katalysatoren die bij 300 °C waren gecalcineerd actiever waren dan de katalysatoren die waren gecalcineerd bij 400 °C, wat consistent was met de activiteitsresultaten.
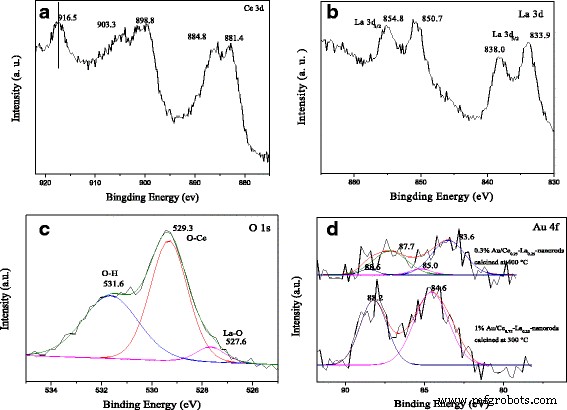
XPS-spectra van 1%Au/Ce0,75 -La0,25 nanostaafjes gecalcineerd bij 300 ° C gedurende 2 uur:Ce 3d pieken (a ), La 3d pieken (b ), en O 1s pieken (c ). Au 4f pieken (d ) van Au/Ce0,75 -La0,25 nanostaafjes gecalcineerd bij 300 en 400 °C gedurende 2 uur
Uv-zichtbaar
Het UV-vis diffuse reflectiespectrum van de Ce0,75 -La0,25 nanostaafjes en 0,5% Au/Ce0,75 -La0,25 nanostaafjes gecalcineerd bij verschillende temperaturen worden weergegeven in Fig. 7. Zoals te zien is in deze figuur, vertoonden de spectra van de katalysatoren die bij verschillende temperaturen waren gecalcineerd, vergeleken met de spectra van de drager, een zwakke en brede absorptieband tussen 500 en 600 nm, wat kenmerkend was voor de oppervlakteplasmonresonantie (SPR) van metallische gouden nanodeeltjes [21, 24, 49]. De SPR zou kunnen worden toegeschreven aan de collectieve oscillaties van elektronen als reactie op optische excitatie, wat zou resulteren in de absorptie van licht in het Uv-vis-gebied. De locatie van de oppervlakteplasmonresonantie werd beïnvloed door de gedispergeerde gouddeeltjesgrootte, de vorm van het deeltje en de diëlektrische eigenschappen van het omringende materiaal. In de huidige studie veroorzaakte de voorbehandeling van het calcineren een grote rode verschuiving van de absorptiebanden, en de posities van de absorptiebanden (500-600 nm) waren rood verschoven bij stijgende calcineringstemperatuur. De shiftrangen zijn als volgt:80 °C→200°C→300°C. Met een verdere verhoging van de calcineringstemperatuur tot 400 °C, verplaatsten de absorptiebanden zich naar de korte golflengte. Er waren verschillende rapporten over de verklaring van verschuivende piekpositie [24, 50.51.52.53]. Hoewel de diameter van het gouddeeltje <-2 nm is, werd de verbrede verschuivende piekpositie voornamelijk veroorzaakt door de grootteafhankelijke demping van de metaaldiëlektrische functie. Er trad ook een verlaging van de elektronendichtheid in de gouddeeltjes op als gevolg van chemische interacties met de omringende metaaloxiden, wat het mechanisme dat tot een roodverschuiving leidt verder zou kunnen verklaren [52]. Een toename van de grootte van de gouddeeltjes zou een blauwe verschuiving in de absorptiepiek veroorzaken (gemiddelde diameter kleiner dan 25 nm), en voor grote deeltjes (gemiddelde diameter groter dan 25 nm) werd het tegenovergestelde effect waargenomen [53]. Volgens de TEM-gegevens was de grootte van de gouddeeltjes in de katalysator <-1 nm voor katalysator gecalcineerd bij 300 ° C. Met een verdere toename van de calcineringstemperatuur tot 400 ° C groeiden de gouddeeltjes echter en de gemiddelde grootte was ongeveer 7 nm. Zoals eerder vermeld, was de positie van de plasmonband sterk afhankelijk van de vorm en de grootte van de gouddeeltjes. In het onderhavige geval kan deze grote verschuiving worden verklaard in termen van het verschil in de grootte van de gouddeeltjes. De gegevens waren consistent met de resultaten van de katalytische activiteitstest. Het gaf ook aan dat gouden nanodeeltjes goed verspreidden over het oppervlak van de dragers.
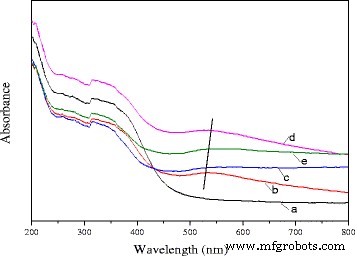
UV-vis DRS van zuiver Ce0,75 -La0,25 nanorod-ondersteuning (a) en 0,3% Au/Ce0,75 -La0,25 nanostaafjes gecalcineerd bij 80 °C (b), 200 °C (c), 300 °C (d) en 400 °C (e)
H2 -TPR
Figuur 8a toont het TPR-profiel voor zuivere en gemengde oxidemonsters. Voor pure CeO2 nanostaafjes, de reductiepiek gecentreerd bij ongeveer lage temperatuur (410 °C) en hoge temperatuur (620 °C) kan worden toegeschreven aan de reductie van oppervlakte- en bulkzuurstofsoorten van CeO2 , respectievelijk [1, 32]. Voor pure La-nanostaafjes konden duidelijke reductiepieken worden gedetecteerd bij ~-700 °C, toegeschreven aan de reductie van bulk La2 O3 . Het was interessant om te ontdekken dat de reductiepieken bij ~ -500 ° C van Ce-La-nanostaafjes verschenen. De reductiepiek van de drie monsters met 25, 50 en 75% at.% La-doping vertoont een verschuiving naar hogere temperatuur met ongeveer 20 °C na La-doping. Bij een La-gehalte van 25 at.% werd een sterk reductiepiektemperatuur van 520°C waargenomen. Het is een nieuwe reductietemperatuur en opmerkelijk vergeleken met die van pure CeO2 nanostaafjes. In vergelijking met de referentie was, vanwege de synergetische interactie tussen La–O en Ce–O, de reductietemperatuur van Ce-La nanostaafjes hoger dan pure CeO2 [31, 54]. Er kon worden vastgesteld dat de binaire oxiden onafhankelijke CeO2 . zouden moeten hebben en LaO x . Zoals getoond in Fig. 8b, verschijnt na de afzetting van goud een nieuwe reductiepiek bij zeer lage temperatuur (100-200 °C) voor Au/CeO2 en Au/La-Ce nanostaafjes. Hier, vanwege XPS-resultaten, nadat de katalysatoren waren gecalcineerd bij 300 °C, was Au voornamelijk Au δ+ , dus de reductiepieken bij ~ -200 ° C worden toegeschreven aan de reductie van Au-soorten in hoge valentie [21]. De kleine piek gecentreerd op ~ -350 ° C kan worden geassocieerd met de reductie van Ce-La-nanostaafjes. Bovendien, voor 1% Au/Ce0,75 -La0,25 nanostaafjes, kan een andere reductiepiek bij ongeveer 230°C worden toegeschreven aan de door goud bevorderde reductie van CeO2 . Eén procent Au/Ce0,75 -La0,25 nanorods has the lowest reduction temperature among the catalysts, which could help it being the most active catalyst for CO oxidation. This was in agreement with the activity results. Since the surface reduction peaks for all oxide supports are significantly decreased after gold deposition, it indicates that most available oxygen is reduced at this lower temperature and suggests that H2 dissociation on gold and spill-over onto the adjacent oxide surface are more likely to be responsible for the strong low-temperature reduction peak [31]. TEM and XPS data indicated that the cationic gold particles with small size highly dispersed on the surface of the supports. The presence of LaO x could also help stabilize cationic Au. This is beneficial for the strength of gold-support interaction [11]. The strong interaction between gold and support promoted the reduction of Au/Ce-La nanorods shifted to low temperature. The results indicated that the reducibility of Ce-La nanorods is strongly affected by the gold deposition.
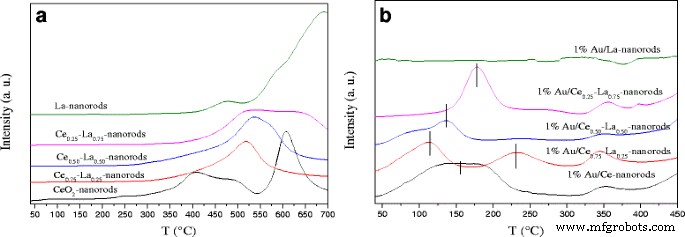
H2 -TPR profiles of a La-Ce nanorods with different La content (0–100 at.%) and b 1% Au/La-Ce nanorods with different La content calcined at 300 °C
Catalytic Activity
Effect of La Content
As shown in Fig. 9, catalytic activity results for Au/Ce-La nanorod samples ranging from pure CeO2 to 100 at.% La-content nanorod supports. The most striking feature in the figure is the high activity of the Au/Ce0.75 -La0.25 nanorod catalyst with the 100% conversion at temperature as low as 30 °C. In contrast, the other Au/La-Ce catalysts showed lower activity compared to Au/Ce0.75 -La0.25 nanorods catalysts under the same reaction conditions. The results indicated that La doping has very much impact on this high CO conversion activity with a La content of 25 at.%, while a further increase results in a significant drop in activity. This again closely mirrors the trends seen in the reducibility of the samples, where an increase of La content from 25 at.% results in a strong loss of reducibility.
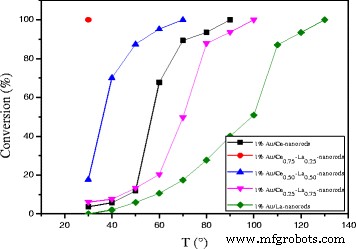
Catalytic activities of 1% Au/ La-Ce nanorods with different La content calcined at 300 °C for 2 h
In consideration of the preparation methods, gold loadings, gold particle size and distribution on different Ce-La nanorods supports, XRD, TEM and XPS data showed that all the catalysts should have the same number and type of active Au sites. So this high activity of the Au/Ce0.75 -La0.25 nanorods catalysts correlates well with the reducibility data discussed above. H2 -TPR results indicated that Au/Ce0.75 -La0.25 nanorods has the lowest reducibility temperature and highest reducibility in the region of 50–400 °C, especially in the region of 50–150 °C, which could exactly approach the region of reaction temperature. In the process of reaction, the Ce0.75 -La0.25 nanorod support served as oxygen carrier. The reducibility of Ce0.75 -La0.25 nanorods could promote the formation of active oxygen. That is to say high reducibility of the catalyst, good activity the catalyst has. Au/Ce0.75 -La0.25 nanorod catalyst subsequently has the best activity.
Effect of Gold Content
The catalytic activities for CO oxidation were measured from low conversion to 100% conversion for the Au/Ce0.75 -La0.25 nanorod catalysts calcined at 300 °C for 2 h with a series of low gold contents. As shown in Fig. 10, all of the catalysts showed high catalytic activities. The CO conversion increased greatly with increasing gold content. The complete CO conversion could be attained at 50 °C over 0.5% Au/Ce0.75 -La0.25 nanorod catalyst. The size and chemical states of gold nanoparticles are generally thought to be vital for the performance of supported gold catalysts. It has been reported that its gold nanoparticles with the diameter of < 5 nm would be suitable for the supported gold catalysts in the catalytic CO oxidation [27, 28]. The XPS data proved that gold in Au/Ce0.75 -La0.25 nanorod catalyst exists in the form of cationic Au + . TEM images of the samples were also shown to investigate the diameter of gold nanoparticles in the catalysts. Consequently, the gold particles of Au/Ce0.75 -La0.25 nanorods were detected as sub-nanometer. Taking into account the particle size, mass content, and chemical states of the gold nanoparticles, gold particles with small diameter highly dispersed on the surface of Ce0.75 -La0.25 nanorods and interacted strongly with the support [17, 21, 23]. The strong interaction between gold particles and the support would help improve CO adsorption and accelerate active oxygen spillover to gold particles from the support, so 0.5% Au/Ce0.75 -La0.25 nanorods which had relatively high content of gold should exhibit the best CO oxidation activity. In fact, 0.5% Au/Ce0.75 -La0.25 nanorods indeed present high performance. The results demonstrated the activity of supported gold catalysts is strongly dependent on the gold nanoparticle size, chemical states, and the quantity of the active species, an increase of which implied an increase of the catalytic activity. In the case of Au/Ce0.75 -La0.25 nanorod catalyst, catalysts with low gold content could also exhibits high activity at low temperature, which would promote the progress of supported gold catalyst. The results indicated that supported gold catalysts prepared by deposition-precipitation with pH value of 6–10 for HAuCl4 solution could have high catalytic activity due to small diameter of gold nanoparticles, corresponding with the references [8,9,10].
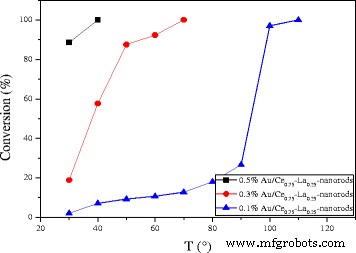
Catalytic activities of Au/Ce0.75 -La0.25 nanorods with different gold goadings calcined at 300 °C for 2 h
Effect of Calcination Temperature
The effect of calcination temperature on the catalytic activity of 0.5%Au/Ce0.75 -La0.25 nanorods is also shown in Fig. 11. The results indicated an increase in the activity of catalyst with the calcination temperature from 80 to 300 °C. The 0.5% Au/Ce0.75 -La0.25 nanorod catalyst calcined at 200 °C could convert CO to CO2 completely at 80 °C. While for 0.5% Au/Ce0.75 -La0.25 nanorod catalyst calcined at 80 °C, the temperature increased to 100 °C. The results showed that CO conversion increased with increasing calcinations temperature. Then, for the sample calcined at 400 °C, about 90% CO can be converted to CO2 at 100 °C and CO could be converted to CO2 completely at 120 °C. The sample calcined at 300 °C possessed the best catalytic activity. The catalytic performance of supported gold catalysts strongly depends on gold nanoparticle size and metal-support interaction due to “synergic effect” at the gold-support interface [10, 13, 15, 18]. The gold-support interaction largely depended on calcination temperature of catalysts. The electron could transfer from gold to the support [10]. Thus, with increasing calcination temperature, the charges on gold particles became increasingly positive, which is good for the enhancement of catalytic activity for CO oxidation. Here, as shown in the Fig. 5, size of gold particles in the catalysts calcined at 300 °C was small. The XPS data also indicated that gold was main Au δ+ after calcination at 300 °C. Thus, the stronger metal-support interaction could account for the relative good catalytic performance for catalysts calcined at 300 °C. From 80 to 300 °C, the higher the calcination temperature is, the stronger interaction exists between gold particles and support. As a consequence, from 80 to 300 °C, the activity of catalysts increased. However, after the 0.5% Au/Ce0.75 -La0.25 nanorod catalyst calcined at 400 °C, complete conversion temperature increased. The main reason might be that the high-temperature treatment led to increased mobility and growth of gold nanoparticles, which correspondingly led to the loss of catalytic activity. The XPS also suggested that the catalysts calcined at 400 °C, Au was mainly Au 0 . It could be concluded that the activities of supported gold nanoparticles were influenced by both the oxidation state and the size of gold nanoparticles, and the appropriate calcination temperature was 300 °C.
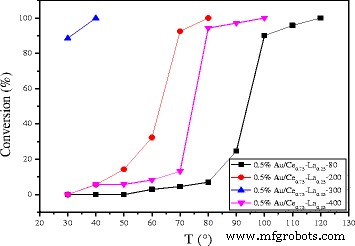
Catalytic activities of 0.5% Au/Ce0.75 -La0.25 nanorods calcined at different temperatures
Stability Observations
The stability of the 0.3% Au/Ce0.75 -La0.25 nanorod catalyst during CO oxidation at different reaction temperatures was measured, as shown in Fig. 12a. When the reaction was carried out at 70 °C, the initial CO conversion over 0.3% Au/Ce-La catalyst can reach 100% and has almost no change with continuously increasing reaction time. 0.3% Au/Ce-La catalyst with 60% CO conversion rate at 40 °C is also attained even after 10-h running period, and no obvious decline in CO conversion is observed. Although the catalytic activity of 0.3% Au/Ce0.75 -La0.25 nanorod catalyst at 40 °C was lower than that of 0.3% Au/Ce0.75 -La0.25 nanorod catalyst at 70 °C, the conversion of CO over the catalysts at both temperatures still seemed to be stable over 10 h on stream. It is thought that the catalyst was of good durability. It was clear that the activity over 0.3% Au/Ce0.75 -La0.25 nanorod catalyst did not strongly depend on the reaction temperature. As the reaction temperature decrease the activation rate barely becomes little slower and then finally reaching a steady state in which the CO conversion was still around 90%. For comparison, the stability of 0.5% Au/Ce0.75 -La0.25 nanorod catalyst at the reaction temperature of 40 °C with initial conversion of 100% was also provided in Fig. 12b. It was obvious that in 10 h, no decrease of CO conversion for 0.5% Au/Ce0.75 -La0.25 nanorods was detected. The results depicted that with the change of gold content, Au/Ce0.75 -La0.25 nanorods could still perform good stability.
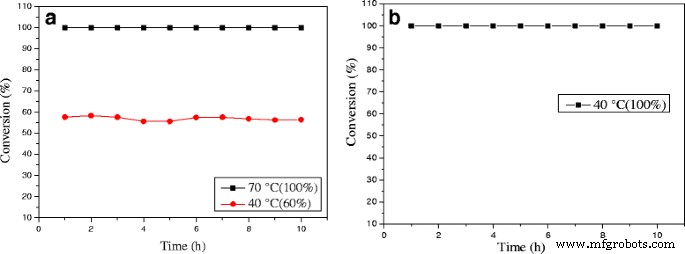
The stability of 0.3% Au/Ce0.75 -La0.25 nanorods, reaction temperature:40 and 70 °C (a ) and 0.5% Au/Ce0.75 -La0.25 nanorods, reaction temperature:40 °C (b ) for the CO oxidation
As engine efficiency increases and automotive exhaust temperatures decrease, traditional supported gold catalysts would be insufficient to meet emission regulations. And there are also a number of industrial catalytic processes which (e. g., the catalytic oxidation of CO in automotive exhaust gas) are sometimes carried out at high temperatures. Thus, the development of new catalysts that are active at lower temperature, yet still stable at periodic high temperatures, will be vital. In the two regards, catalysts with good activity at low temperature that are stable at high reaction temperatures are desirable. It is necessary to investigate their catalytic performance for CO oxidation at a certain high temperature which is a very stringent test for the stability of gold nanocatalysts against sintering. In the present work, the stability of 0.3% Au/Ce0.75 -La0.25 nanorod catalyst was also measured at 200 °C (100%) for high-temperature treatment. As shown in Fig. 13, no decline of catalytic activity was observed within 50 h indicates that the catalyst keeps good stability within 50 h. Remarkably, very few serious gold sintering occurred during the reaction. It indicated that 0.3% Au/Ce-La catalyst can exhibit good catalytic stability at both low and high reaction temperatures.
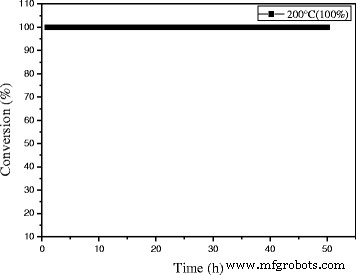
The stability of 0.3% Au/Ce0.75 -La0.25 nanorods at the reaction temperature of 200 °C for CO oxidation
Reaction Mechanism Speculate
Combined with H2 -TPR and XPS experiments, it suggested that CO oxidation over LaO x -doped CeO2 -supported Au catalysts might follow the Langmuir–Hinshelwood + Redox mechanism [1, 20, 26, 30, 32]. The XPS results suggest that there are Ce 3+ and Ce 4+ on the surface of the catalyst. H2 -TPR data also proved that reducibility of this binary Ce-La nanorod oxides could be promoted by Au deposition. The reducibility of Au/Ce-La nanorods was much higher than pure Au/CeO2 or Au/LaO x catalysts. This would help the produce of oxygen vacancies. The oxygen vacancy is a very lively activity center. The active center can promote the activation of O2 . Thus, the CO oxidation reaction could become more easily. There are also amount of adsorbed oxygen species on the surface of catalyst. Usually adsorbed oxygen species play an important role in the oxidation of CO. The O2 of the reaction will form the chemisorbed oxygen, and the oxygen vacancy would be replenished by O2 of reaction gas to form new active lattice oxygen. XPS data also proved that gold in the catalysts was mainly Au δ+ species, which would accelerate the adsorption of CO. The possible reaction mechanisms of Au/Ce-La nanorod catalyst could be described as follows. Firstly, CO and O2 were chemisorbed on the surface of the catalysts. Then, the chemisorbed oxygen directly reacts with CO, or the active lattice oxygen of the catalyst reacts with CO, and the catalyst produced the oxygen vacancy with oxygen from gas-phase O2 . At last, CO was oxidized into CO2 (shown in Fig. 14).
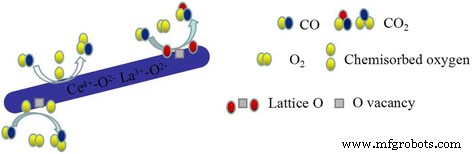
Proposed CO reaction pathways over the catalysts, Au/Ce-La nanorods
Conclusies
In summary, a series of mixed Ce-La nanorods with various amounts of La was prepared via a simple hydrothermal reaction at high concentration of NaOH and without surfactant. Gold was loaded by deposition-precipitation. After La doping, the composite could retain the initial rod morphology. As a result, Ce-La nanorods with 25 at.% La maintained the optimal nanorods with the length of 0.6 um and the diameter of 3–5 nm. Gold particles were dispersed well on the support. The reducibility of Ce-La nanorods could be affected significantly by LaO x doping. The deposition of gold had important influence on the reducibility of catalyst. Thus, the CO oxidation activity of Au/Ce-La nanorods was essentially changed in comparison with pure Au/CeO2 and Au/La nanorods. One percent Au/Ce0.75 -La0.25 nanorods could convert CO to CO2 completely at 30 °C. Further increase in La content results in decreased activity due to the decrease in reducible oxygen sites. The Au/Ce0.75 -La0.25 nanorod catalyst with low gold concentration also showed high activity. With the increase of gold content, there is an increase in the activity. The stability test of 0.3% Au/Ce0.75 -La0.25 nanorods indicated that the catalyst not only kept 100% conversion after continuous operation for 10 h under 70 °C but also showed no deactivation after 10 h on stream at 40 °C. As expected, the activity of 0.3% Au/Ce0.75 -La0.25 nanorods also retained a 100% CO conversion during 50 h at 200 °C. The results revealed that LaO x as the dopant could grow together with CeO2 in one rod. The 1D binary mixed Ce-La nanorods could be a good support for precious metal group catalysts with low content of gold.
Nanomaterialen
- Vooruitgang en uitdagingen van fluorescerende nanomaterialen voor synthese en biomedische toepassingen
- Biogene synthese, karakterisering en antibacteriële potentiële evaluatie van koperoxide-nanodeeltjes tegen Escherichia coli
- Synthese van elektrisch geleidende silica nanovezel/gouden nanodeeltjescomposiet door laserpulsen en sputtertechniek
- Bioveiligheid en antibacterieel vermogen van grafeen en grafeenoxide in vitro en in vivo
- Synthese van ZnO-nanokristallen en toepassing in omgekeerde polymeerzonnecellen
- Vastestofverwarmingssynthese van poly (3,4-ethyleendioxythiofeen)/goud/grafeencomposiet en de toepassing ervan voor Amperometrische bepaling van nitriet en jodaat
- Gemakkelijke synthese van wormgatachtig mesoporeus tinoxide via verdamping-geïnduceerde zelfassemblage en de verbeterde gasdetectie-eigenschappen
- One-Pot-synthese van Cu2ZnSnSe4-nanoplaten en hun door zichtbaar licht aangedreven fotokatalytische activiteit
- Platycodon-saponinen van Platycodi Radix (Platycodon grandiflorum) voor de groene synthese van gouden en zilveren nanodeeltjes
- Groene synthese van metaal- en metaaloxidenanodeeltjes en hun effect op de eencellige alg Chlamydomonas reinhardtii
- Eigenschappen van zinkoxide-nanodeeltjes en hun activiteit tegen microben



