Zebravis:een veelbelovend real-time modelsysteem voor door nanotechnologie gemedieerde neurospecifieke medicijnafgifte
Abstract
Het afleveren van medicijnen aan de hersenen is altijd een uitdaging gebleven voor de onderzoeksgemeenschap en artsen. De bloed-hersenbarrière (BBB) fungeert als een belangrijke hindernis voor het afleveren van medicijnen aan specifieke delen van de hersenen en het centrale zenuwstelsel. Het bestaat fysiologisch uit een complex netwerk van haarvaten om de hersenen te beschermen tegen invasieve stoffen of vreemde deeltjes. Daarom is er een absolute behoefte aan begrip van de BBB voor succesvolle therapeutische interventies. Recent onderzoek wijst op de sterke opkomst van de zebravis als een model voor het beoordelen van de permeabiliteit van de BBB, die sterk geconserveerd is in zijn structuur en functie tussen de zebravis en zoogdieren. Het zebravismodelsysteem biedt een overvloed aan voordelen, waaronder eenvoudig onderhoud, hoge vruchtbaarheid en transparantie van embryo's en larven. Daarom heeft het de potentie om te worden ontwikkeld als een model voor het analyseren en ophelderen van de permeabiliteit van BBB voor nieuwe permeatietechnologieën met neurospecificiteit. Nanotechnologie is nu een aandachtsgebied geworden binnen de industriële en onderzoeksgemeenschap voor het afleveren van medicijnen aan de hersenen. Nanodeeltjes worden ontwikkeld met verhoogde efficiëntie en nauwkeurigheid voor het overwinnen van de BBB en het afleveren van neurospecifieke medicijnen aan de hersenen. De zebravis is een uitstekend modelsysteem om de biocompatibiliteit en toxiciteit van nanodeeltjes te beoordelen. Daarom is het zebravismodel onmisbaar voor de ontdekking of ontwikkeling van nieuwe technologieën voor neurospecifieke medicijnafgifte en potentiële therapieën voor hersenziekten.
Inleiding
Geneesmiddelafgifte verwijst naar de methode voor het overbrengen van verbindingen naar het lichaam voor therapeutische doeleinden. De verbindingen zijn voornamelijk farmaceutisch van aard en gericht tegen een bepaalde ziektetoestand op een bepaalde celpopulatie in vivo. De term medicijnafgifte omvat twee hoofdideeën:vorm van dosering en toedieningsweg [1]. Een juiste medicijnafgifte zorgt voor een efficiënte medicijnactiviteit door het volgende te reguleren:medicijnafgifte, absorptie door cellen en correcte distributie binnen het systeem [2]. Enkele veelgebruikte routes voor medicijnafgifte zijn enterale (maagdarmkanaal), parenterale (via injecties), inhalatie (olfactorisch gemedieerd), transdermaal (via dermis), topische (via de huid) en orale routes (via slokdarm) [3]. Het afleveren van een medicijn is van cruciaal belang en van groot belang op het gebied van therapieën. De gekozen methode moet het meest effectief zijn en ook het minst toxisch voor het systeem [4]. Het probleem wordt nog groter als het orgaan in kwestie de hersenen zijn. Het afleveren van medicijnen aan de hersenen is al tientallen jaren een strijd onder onderzoekers [5, 6]. Er zijn talloze technologieën en ideeën gebruikt voor de ontwikkeling van een effectieve techniek [7, 8]. Toch lijkt succes niet te dichtbij. De grootste hindernis in deze strijd is het vermogen om de bloed-hersenbarrière (BBB) te passeren. De BBB is een fysiologische barrière om onze hersenen te beschermen tegen verbindingen die van het bloed naar de hersenen worden overgebracht [9]. Door de natuurlijke samenstelling van de barrière hebben alleen zeer kleine moleculen in de bloedbaan toegang tot de hersenen [10]. Moleculen met een klein molecuulgewicht < 400 Da en die welke in vet oplosbaar zijn, hebben het vermogen om de hersenen binnen te dringen [11]. Neurospecifieke medicijnen moeten aan deze parameters voldoen voor een effectieve medicijnafgifte over de BBB. Op dit moment slagen de meeste medicijnen die zijn ontwikkeld om zich op de hersenen te richten, niet in het oversteken van de BBB [9, 12, 13]. Ziekten van het centrale zenuwstelsel zijn enkele van de meest voorkomende ziekten die verschillende mensen in alle levensfasen treffen. Deze ziekten blijven echter nog steeds het minst behandeld [14]. Er is een onmiddellijke behoefte aan nieuwe neurospecifieke technologieën voor het afleveren van medicijnen, aangezien de succespercentages van bestaande medicijnen die op de hersenen zijn gericht extreem laag zijn. Afgezien van de beperkte permeabiliteit van de BBB, moet ook rekening worden gehouden met de complexiteit van de hersenen en de bijwerkingen die worden veroorzaakt door bestaande technologieën voor medicijnafgifte [15]. Het ontbreken van een absolute methode voor efficiënte afgifte van neurospecifieke geneesmiddelen heeft een effectieve ontwikkeling van geneesmiddelen op dit gebied belemmerd. De onderzoeksgemeenschap heeft verschillende wegen onderzocht om veilige en gerichte medicijnen aan de hersenen te leveren. Macromoleculen tot nanodeeltjes worden onderzocht om maximale effectiviteit te garanderen [16].
Nanotechnologie heeft in toenemende mate de belangstelling van de wetenschappelijke gemeenschap gekregen door de enorme impact ervan op onderzoek naar de toediening van hersendrugs [17]. Met de groei in nanotechnologie is er een gelijktijdige uitbreiding van de nanotoxicologiesector geweest. De beoordeling van de toxiciteit van de nanodeeltjes speelt een cruciale rol bij het analyseren van de impact van de nanodeeltjes op de individuele soort en het milieu in het algemeen [18]. De afgelopen jaren is de zebravis toegepast als prototype voor toxiciteitsstudies [19]. De zebravis is uitgebreid gebruikt voor studies over experimentele biologie en ontwikkelt zich nu als een robuust modelsysteem om nanotoxiciteit te bestuderen [20]. In termen van modelsysteem voor nanotoxiciteit biedt de zebravis verschillende voordelen. Het is zeer zuinig in gebruik als proefdier en gemakkelijk te onderhouden. Het heeft een hoge vruchtbaarheid waardoor ze gemakkelijk beschikbaar zijn en helpt om de fysiologie van gewervelde dieren op een gemakkelijkere manier te begrijpen [21]. Het gebruik van de zebravis als modelsysteem heeft echter ook zijn beperkingen. Eerst en vooral is het zenuwstelsel van de zebravis misschien niet zo ingewikkeld en ontwikkeld als dat bij mensen; het zenuwstelsel van knaagdieren en muizen is relatief beter ontwikkeld en kan worden gebruikt om de complexe menselijke hersenziekten te bestuderen; ze zijn echter niet identiek aan die van mensen [22]. Ten tweede mist de zebravis sommige orgaansystemen die bij mensen worden gevonden, zoals de longen, de prostaat en de borstklieren; ook kunnen ziekten veroorzaakt door genen die afwezig zijn in de zebravis niet worden bestudeerd [23]. De zebravis deelt echter 70% genomische gelijkenis met het menselijk genoom en 84% homologie met menselijke ziekteverwekkende genen, waardoor het zeer geschikt is om menselijke ziektepathologie na te bootsen [24]. Eerder werd aangenomen dat de volwassen zebravis geen levermacrofaag bevat; de Kupffer-cellen werden beschouwd als slechts tijdelijk aanwezig in het vroege embryonale stadium en afwezig of schaars in latere stadia van ontwikkeling [25,26,27]. Recent werk heeft echter de hematopoëtische oorsprong van de Kupffer-cellen aangetoond en hun persistentie, zelfs in de lever van de volwassen zebravis, waardoor zebravissen ook bedreven zijn in onderzoek naar Kupffer-cellen [28, 29]. Verder wordt verwacht dat de hogere gewervelde modellen de gecompliceerde menselijke pathologieën nauwkeuriger nabootsen dan de zebravis. Onlangs is er een debat op gang gekomen over het vertrouwen op beschikbare gegevens van diermodellen en hun extrapolatie naar mensen [30]. Dit wijst op het feit dat elk diermodel zijn eigen beperkingen heeft wanneer het wordt toegepast op klinische studies [30, 31].
Deze review bespreekt de meest recente studies over door nanotechnologie gemedieerde medicijnafgifte specifiek aan de hersenen met behulp van de zebravis als modelsysteem. Het vat de hindernissen van de BBB en de verschillende optimalisaties van nanodrugs samen, hun evaluatie van de toxiciteit en hun impact als gebruik voor therapieën bij neurodegeneratieve ziekten met behulp van zowel zebravisembryo's als volwassenen. Ten slotte benadrukt de review de voor- en nadelen van het zebravismodel voor neurospecifieke medicijnafgifte en brengt het de immense reikwijdte aan het licht die het biedt voor toekomstig translationeel onderzoek.
Bloed-hersenbarrière:het belangrijkste obstakel bij de toediening van neurospecifieke geneesmiddelen
De BBB zorgt voor een beperkte binnenkomst van stoffen in de hersenen, en fungeert dus als een diffusiebarrière die helpt om de normale hersenhomeostase te behouden [32]. Verschillende cellen zijn betrokken bij het vormen van de composietstructuur van de BBB [33]. Pericyten, astrocyten en neuronen vormen de cellulaire componenten, terwijl de endotheelcellen, tight junctions en basale membraan samen de BBB vormen [34]. Het ontbreken van fenestraties in de endotheelcellen in de hersenen zorgt ervoor dat er geen diffusie van kleine moleculen over hun oppervlak plaatsvindt. Zelfs in water oplosbare stoffen worden belemmerd om de hersenen binnen te komen door de aanwezigheid van inter-endotheliale junctions zoals tight junctions, adhesieve junctions en gap junctions, die de endotheelcellen met elkaar verbinden [35]. Deze endotheelcellen zijn op hun beurt omgeven door de pericyten, astrocyten en basale membraan die de structuur van de BBB voltooien [36]. De aanhangende junctions en tight junctions reguleren de permeabiliteit van de endotheelcellaag. Gap junctions bestaan uit connexine-moleculen en ze regelen de communicatie tussen endotheelcellen [37]. Moleculen kunnen de BBB passeren via twee routes:de paracellulaire route of de transcellulaire route [38]. In de paracellulaire route passeren de ionen en moleculen de BBB door passief tussen de cellen te diffunderen met behulp van een concentratiegradiënt [39]. De transcellulaire route maakt gebruik van verschillende mechanismen zoals transcytose of receptor-gemedieerd transport voor de passage van moleculen door de cellen [40]. Verschillende parameters beïnvloeden de doorlaatbaarheid van de BBB. Molecuulgewicht, lading op het oppervlak, oppervlakteactiviteit, oplosbaarheid van het molecuul en relatieve grootte van het molecuul hebben invloed op de BBB-permeabiliteit [41].
Bloed-hersenbarrière:moderne technologieën voor medicijnafgifte
De bloed-hersenbarrière (BBB) in gezonde hersenen werkt voornamelijk als een diffusiebarrière om de normale hersenfuncties te beschermen. Het voorkomt dat de meeste verbindingen van het bloed naar de hersenen worden overgebracht. De strenge BBB laat alleen zeer kleine moleculen de hersenen binnen; er wordt echter waargenomen dat het wordt verstoord in ziektetoestanden.
Waarom nanodeeltjes een huidige keuze zijn voor neurospecifieke medicijnafgifte
De techniek van het engineeren en synthetiseren van materialen op moleculair niveau wordt nanotechnologie genoemd. Het National Nanotechnology Institute definieert nanotechnologie als elk materiaal dat in ten minste één dimensie bestaat en in grootte varieert tussen 1 en 100 nm (Fig. 1). Het laatste decennium is er een hausse geweest op het gebied van nanotechnologie en de toepassingen ervan in de biomedische sector. Aangenomen wordt dat de toediening van medicijnen op basis van nanotechnologie de hele biotechnologische en farmaceutische industrie in beweging heeft gebracht en de komende jaren een diepgaande verandering op dit gebied zal brengen [42,43,44,45,46,47]. De toepassing van nanotechnologie belooft verschillende voordelen bij gerichte medicijnafgifte. Deze omvatten het vermogen om geneesmiddelen (a) die minder oplosbaar zijn in water af te leveren op hun respectievelijke doellocatie, (b) van twee of meer typen voor het bereiken van combinatorische therapie, (c) gerichte toediening op de specifieke plaats van actie, (d) transport van medicijnen over nauwe barrières heen, dwz bloed-hersenbarrière, (e) visualisatiemogelijkheden voor een beter begrip en analyse van de medicijnactiviteit [48] en (f) realtime trackingfaciliteit voor het bereiken van perfecte werkzaamheid in de modus van medicijnactiviteit [44]. De nanotechnologietechniek heeft dus een enorm potentieel voor neurospecifieke therapieën.
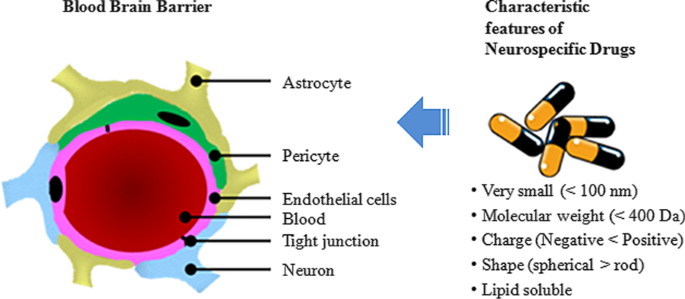
Kenmerken van neurospecifieke medicijnen. De BBB bestaat typisch uit de tight junctions in de endotheelcellen, omringd door de astrocyten, pericyten en neuronen. Neurospecifieke moleculen moeten specifieke eigenschappen hebben om de bloed-hersenbarrière (BBB) te kunnen passeren. Voorkeurskenmerken zijn:zeer klein formaat met een diameter van minder dan 100 nm, laag molecuulgewicht bij voorkeur minder dan 400 Da, moet positief geladen zijn, bolvormig en oplosbaar in lipiden
Zebravis als model voor neurospecifieke medicijnafgifte
De Danio rerio (zebravis) is een gedemonstreerd model van gewervelde dieren voor het onderzoeken van ontwikkelingsstudies en de studie van degeneratieve ziekten [49.50.51.52]. Het kan worden gemodelleerd voor verreikende analyses, van fundamentele en toxicologische analyse tot preklinische studies [53,54,55]. Van de verschillende voordelen die de zebravis biedt, zijn het kosteneffectieve onderhoud, het gemakkelijke testen met eenvoudige huisvestingsvereisten en een grote koppelingsmaat zeer geschikt voor testen met een hoge doorvoer [56]. Hoge vruchtbaarheid is een onderscheidend kenmerk dat het gebruik van dit modelsysteem verder accentueert [24, 57]. De orgaansystemen van zebravissen zijn sterk geconserveerd tot die van hogere gewervelde dieren [58].
De zebravisembryo's hebben een uitwendige ontwikkeling en zijn volledig transparant waardoor ze uitgebreid visueel kunnen worden bestudeerd. Ze zijn dus een uitstekend hulpmiddel voor screeninganalyses met middelen die de normale groei, ontwikkeling en celcyclus verstoren [59]. Ze vertonen grondige ontwikkelingspatronen, variërend van epiboly tot de uiteindelijke ontwikkeling van sleutelstructuren [60, 61]. Zebravissen worden nu op grote schaal gebruikt voor neuropsychiatrisch onderzoek en verschillende onderzoeken om ontwikkelingstoxiciteit bij door nanodeeltjes gemedieerde medicijnafgifte te analyseren. Blootstelling van zebravissen aan gouden nanodeeltjes verstoorde de normale oogontwikkeling en pigmentatie zoals waargenomen via een eenvoudige lichtmicroscoop [62, 63]. Het toedienen van gouden nanodeeltjes aan zebravissen resulteerde in genotoxische effecten en ernstige veranderingen in hun genoomsamenstelling [64]. De dosis- en tijdsafhankelijke toxiciteit van silica NP's werd bepaald door de impact ervan op het cardiovasculaire systeem [65, 66] en op de sterftecijfers [67] te analyseren. Er werd ook gevonden dat chitosan-NP's een hogere compatibiliteit hebben in vergelijking met normaal chitosan [68].
Het is absoluut noodzakelijk dat nanodeeltjes die worden gebruikt voor klinische interventies biologisch afbreekbaar en niet-toxisch zijn. Nanodeeltjes hebben een groot potentieel op het gebied van gerichte medicijnafgifte en translationeel onderzoek. Het gebruik van nanodeeltjes is toegepast op een steeds groter aantal gebieden, waaronder in vivo toepassingen. Deze brede toename van het gebruik van de nanodeeltjes impliceert het op de loer liggende gevaar van overmatige blootstelling van deze nanodragers aan de mens. Toxiciteitsstudies van de nanodeeltjes zijn een onmisbaar onderdeel van nanotechnologie. Er moeten studies worden uitgevoerd die zich richten op interacties tussen nanodeeltjes op cellulair en moleculair niveau om de toxiciteit te analyseren voordat ze klinisch kunnen worden gebruikt. Tabel 1 vat de neurotoxiciteitsstudies samen van diverse nanocarriers die worden gebruikt voor hersengerichte medicijnafgifte met behulp van zebravissen. Toxiciteit van nanodeeltjes omvat het analyseren van de toxiciteit, permeabiliteit, mortaliteit, geïnduceerde teratogeniteit, immuunreacties en genomische toxiciteit.
De zebravis wordt veelvuldig gebruikt als een modelsysteem om de toxiciteit en biocompatibiliteit van nanodeeltjes te evalueren [111,112.113], en het heeft een groot potentieel als model voor het bestuderen van neurotoxiciteit en screening met hoge doorvoer van nanodeeltjes [114,115,116,117]. Geen enkel ander model dan de zebravis is zo geschikt voor dergelijke analyses. Dit modelsysteem kan worden gebruikt om de risico's van toxiciteit van nanomaterialen te bestuderen, analyseren en beheersen. De verkregen informatie zal nuttig zijn bij het formuleren van specifieke richtlijnen, het formuleren van beschermende maatregelen en kwaliteitscontroles tijdens het werken met nanotechnologie-gerelateerde producten [118, 119].
Inzichten over door nanodeeltjes gemedieerde medicijnafgifte met behulp van zebravisembryo's
Om nanodeeltjes te gebruiken voor het richten op de hersenen, is een voorkennis over hun effecten in vivo essentieel. Het zebravismodel is hiervoor het meest geschikt. Recente studies zijn uitgevoerd met behulp van nanodeeltjes om essentiële inzichten te verkrijgen in het uitkomen van zebravislarven. Gebruik van TiO2 nanodeeltjes induceren het vroeg uitkomen van de larven op een dosisafhankelijke manier [120]. Chen et al. suggereren dat TiO2 nanodeeltjes hebben invloed op het zwemgedrag van larven en beïnvloeden zowel de snelheid als het activiteitsniveau [121]. Aan de andere kant, Ong et al. rapporteerde volledige remming van het uitkomen en embryonale dood van larven bij blootstelling aan nanodeeltjes. Ze voegden eraan toe dat de doodsoorzaak van embryo's eerder de fysieke interactie van de nanodeeltjes met de embryo's is dan de effecten van de fysisch-chemische eigenschappen van de nanodeeltjes [122]. Verstoring van het endocriene systeem van de schildklier in de zebravislarven is ook waargenomen wanneer ze worden blootgesteld aan TiO2 nanodeeltjes [123]. Ophoping van lood is toegeschreven aan de oorzaak van dit nadelige effect. TiO2 Van nanodeeltjes is ook gemeld dat ze de expressieniveaus van BDNF, C-fos en C-jun aanzienlijk activeren. Omgekeerd bleek het ook een remmend effect te hebben op genen zoals p38, NGF en CRE, resulterend in hersenbeschadiging van zebravissen [124]. TiO2 Het is ook aangetoond dat nanodeeltjes nadelige effecten hebben op het voortplantingsvermogen van de vissen, waardoor het aantal eieren dat wordt vrijgelaten met 9,5% wordt verminderd [125]. Vogt et al. rapporteerde verder de chemische toxiciteit van het kleine molecuul BCI wanneer toegevoegd aan zebravisembryo's 24-48 uur na de bevruchting [126]. Ali en Legler et al. toonde door nonylfenol nanodeeltjes geïnduceerde misvormingen in de embryo's, zelfs bij een lage dosis [127]. Usenko et al. geëvalueerd koolstoffullereen [C60 , C70 , en C60 (OH)24 ]-geïnduceerde toxiciteit met behulp van zebravisembryo's [128], terwijl Daroczi et al. somde het beschermende potentieel van hetzelfde nanomateriaal op tegen ioniserende straling [129]. Neuroprotectief effect van C60 fullereenderivaat, dendrofullereen nanodeeltje (DF-1), in de zebravisembryo's is ook gerapporteerd door de toxiciteit ervan te beoordelen [129]. Toediening van silica-nanodeeltjes aan de vissenembryo's resulteerde in verhoogde mortaliteit [67], terwijl ZnO-nanodeeltjes de mortaliteit verhoogden en ook huidulcera veroorzaakten met vertraging bij het uitkomen [82]. De impact van blootstelling van watergedragen nanodeeltjes op genen die het immuunsysteem reguleren, werd voor het eerst gerapporteerd door Brun et al. [130]. Deze studie benadrukt het belang van moleculaire reacties als indicatoren van biologische toxiciteit. Zebravisembryo's geënt met kankercellen en onderworpen aan polymersoom nanodeeltjes zijn in realtime in beeld gebracht om de toxiciteit en behandelingsstrategie van nanodeeltjes te begrijpen [131].
Interessant is dat bio-imaging met behulp van zebravisembryo's van verschillende ontwikkelingsstadia de toxische effecten van met natriumcholaat ingekapselde Ag-nanodeeltjes aan het licht bracht [132, 133]. Deze studie is van enorm belang [134] omdat het aantoont dat toxiciteit die voortkomt uit Ag-nanodeeltjes de ontwikkeling van de kieuwen en lamellen in de vissen beïnvloedt. Dit remmende effect wordt voornamelijk veroorzaakt door interactie van Ag-ionen in de kieuwen waar ze de Na + /K + ATPase-activiteit blokkeren [135, 136]. Verder is gemeld dat Cu-nanodeeltjes een vergelijkbaar remmend effect hebben op de groei van kieuwen in de vissen [76]. Het gebruik van koperen nanodeeltjes in de larven leidde tot misvorming en vertraagd uitkomen [69, 76]. Toepassing van gouden nanodeeltjes had geen toxisch effect op de larven [69], terwijl zilveren nanodeeltjes de ontwikkeling beïnvloedden [137]. Nanodeeltjes gemaakt van zink, magnesium, ijzer, koper en nikkel waren niet giftig voor de volwassenen, maar bij de larven is vertraagd uitkomen waargenomen [78, 79, 81, 82, 138]. Het is ook aangetoond dat nanodeeltjes van de organische verbinding fullereen niet-toxisch zijn voor larven bij concentraties lager dan 200 mg/L [139]. Verder werd ook aangetoond dat nanodeeltjes van chitosan veel effectiever en niet-toxischer waren in vergelijking met de gebruikelijke chitosandeeltjes [68].
Metaaloxide nanodeeltjes zoals TiO2 er is gemeld dat het enkele ontwikkelingsmisvormingen in de zebravislarven [120] induceert, terwijl sommigen melden dat het volledig niet-toxisch is [140, 141]. De cruciale parameter hier is zowel de dosering als de blootstellingstijd. Hogere doses van de TiO2 NP's blijken dodelijk te zijn voor de larven met ophopingen van de NP in de kieuw, het hart, de lever en de hersenen [141, 142]. Genotoxische effecten zijn ook het gevolg van blootstelling aan hoge doses TiO2 naar de vis [143]. Chronische blootstelling aan lagere concentraties (< 4 mg/L) TiO2 NP's leiden tot een lagere toxiciteit en een hoger sterftecijfer [142]. Een ander belangrijk kenmerk van een nanodeeltje waarmee rekening moet worden gehouden, is de vorm van het nanodeeltje en de eiwitten op het oppervlak. Zeshoekige kristallen met korrelkolommen van ZnO NP's hadden invloed op de celcyclus van de zebravis [144], terwijl ZnO NP's die bladvormig waren en bedekt waren met polymeer een hogere biocompatibiliteit vertoonden in vergelijking met de bolvormige NP's [122]. Verder is aangetoond dat nanosticks giftiger zijn dan bolletjes en kubusvormige nanodeeltjes [145]. IJzer-NP's leiden tot ernstige misvormingen bij de larven [146] en genotoxische effecten bij volwassenen [134], terwijl is bewezen dat metalen zoals nikkel, kobalt en aluminium NP's relatief inert zijn [82, 147].
Gezien de toegenomen verwoesting veroorzaakt door plastic in de wereld van vandaag, Pitt et al. toonde zijn impact op de zebravis. Ze merkten op dat de zich ontwikkelende zebravissen zeer gevoelig zijn voor het nanoplastic dat beschikbaar is in de aquatische ecosystemen. Deze nanodeeltjes kunnen het chorion binnendringen en een sombere invloed hebben op hun fysiologie en gedragsreacties [148]. Deze studie gaat verder met het ophelderen van de overlast die plastic veroorzaakt voor de onderwaterwereld, wat op zijn beurt gevolgen heeft voor de menselijke beschaving. Onderzoek wijst uit dat zeer kleine nanodeeltjes met een hoge oppervlakte/volumeverhouding zeer goed in staat zijn om verontreinigende stoffen uit de omgeving te absorberen. Het gebruik van polystyreen nanoplastic kralen in cosmetische producten is onderzocht op hun ontwikkelingstoxiciteit en impact op zebravisembryo's [149]. Een ander onderzoek naar nanoplastic van polystyreen met een grootte van minder dan 20 nm heeft aangetoond dat het zich ophoopt in de hersenen van de embryo's [150].
Inzichten onthuld door nanodeeltjesstudies bij volwassen zebravissen
Er is relatief veel onderzoek gedaan naar de effecten van nanodeeltjes op volwassen zebravissen. Het fungeert als een waardevolle bron van informatie over het gebruik van nanodeeltjes bij gewervelde dieren. Truong et al. evalueerde gedragsafwijkingen die ontstonden in 122 dpf-embryo's door blootstelling aan gouden nanodeeltjes [151]. Geneesmiddelafgifte aan de huid is ook bereikt door het toedienen van nanodeeltjes aan de zebravis. Onderzoekers hebben aangetoond dat de Ag-BSA-nanodeeltjes de huid binnendringen door endocytose, waar ze zich ophopen en huidafwijkingen veroorzaken [63]. Het afleveren van medicijnen via nanodeeltjes is ook gebruikt om stresscondities bij de zebravis te induceren om te fungeren als potentiële modellen voor het ontdekken van medicijnen [152]. Van sommige nanodeeltjes is aangetoond dat ze astma, apoptose en een verhoogde immuunrespons bij vissen induceren, waardoor ze kunnen worden gebruikt voor immunotoxicologische studies [153,154,155,156]. Het zebravismodel is uitgebreid onderzocht op door geneesmiddelen geïnduceerde cardiotoxiciteit [157, 158]. Het hart van een zebravis vertoont verschillende vergelijkbare functionele kenmerken als dat van een menselijk hart, inclusief de farmacologische reacties op geneesmiddelen [159.160.161.162]. Het hart van de zebravis is het eerste dat zich ontwikkelt bij 22 pk, terwijl het hele cardiovasculaire systeem klaar is bij 48 pk [163]. De zebravisembryo's zijn gevisualiseerd om de effecten van geneesmiddelen op hartslag, ritmiek, contractiliteit en bloedsomloop te bestuderen. Er zijn verschillende visuele testen uitgevoerd met behulp van de zebravis om de gezondheid van het hart te helpen uitwerken. Een QT-interval is een van de parameters waarop de meeste hartmedicijnen zijn gebaseerd. Het QT-interval is het tijdsverschil tussen een Q- en een T-golf in de elektrische cyclus van het hart. Een aantal medicijnen is beoordeeld op hun effect op het QT-interval (duur van de ventriculaire actiepotentiaal) met behulp van zebravissen [164,165,166]. Een van de onderzoeken meldde dat het medicijn dat een verlenging van het QT-interval bij mensen veroorzaakt, in feite leidt tot bradycardie en auriculaire ventriculaire geleiding blokkeert [160]. De zebravislever vormt zich met 48 pk en wordt volledig functioneel met 72 pk; dit modelsysteem wordt veel gebruikt om levergebaseerde medicijnafgifte te bestuderen. Studies op dit gebied hebben aangetoond dat de reactie van de zebravis op levertoxiciteit vergelijkbaar is met die van de hogere gewervelde dieren [167]. De zebravissen zijn gebruikt om de orthologen van cytochroom P450, CYP3A en CYP3A65 te karakteriseren [168, 169]. Er zijn verdere beoordelingen uitgevoerd om het effect van het geneesmiddel op CYP3A4, CYP2D6 en CYP3A65 [170] uit te werken. Neuroprotectieve effecten van nanoformuleringen van hesperetine zijn onderzocht in een model voor traumatisch hersenletsel van zebravissen [171].
Zebravis biedt een compleet pathologisch studiemodel voor neurospecifieke medicijnafgifte
Bij het afleveren van medicijnen aan de hersenen kunnen verschillende nadelige effecten optreden. Het zebravismodel biedt het voordeel deze in detail te bestuderen en biedt dus een geschikte techniek voor medicijnafgifte aan de hersenen [172]. Teratogeniteit:Elke vorm van abnormale teratogene groei of ontwikkeling kan gemakkelijk worden beoordeeld door de transparante zebravisembryo's [59] te observeren. Van de belangrijkste verstoringen die kunnen worden waargenomen tijdens de vorming van teratoom zijn de pigmentatie van het oog [67], sterftecijfers [65], veranderingen in het cardiovasculaire systeem [68] en effecten op het uitkomen [115]. Immunotoxiciteit:Er is onderzoek gedaan naar de immunologische reacties die optreden bij de zebravis als reactie op medicijnen of nanodeeltjes. Dit leidt tot accumulatie van neutrofielen en macrofagen [173]. Van het gebruik van gouden nanodeeltjes is gemeld dat het inflammatoire immuunresponsen [174] verstoort, terwijl aan de andere kant is aangetoond dat zilveren nanodeeltjes ontstekingsreacties induceren [175]. Genotoxiciteit:Veranderingen die optreden op DNA-niveau kunnen worden waargenomen door real-time PCR [143] en andere komeetassays [134]. Recent onderzoek naar op koolstof gebaseerde NP's heeft de laatste tijd meer aandacht getrokken [176], voornamelijk vanwege hun lage toxiciteit [177]. Koolstof-NP's worden in verschillende vormen gebruikt in zebravissen, waaronder fullerenen [128], koolstofnanodeeltjes, koolstofnanobuisjes (CNT) [178], grafeen-QD's [179] en koolstof-QD's (C-dots) [180]. Allotropen van koolstof zoals fullerenen zijn ook gebruikt als NP's sinds hun ontdekking in 1985. Ze zijn op grote schaal gebruikt voor toepassingen voor medicijnafgifte [181, 182]. Studies bij zebravissen hebben aangetoond dat de toxiciteit van fullereen-NP's afhankelijk is van de lading op het oppervlak. Positief geladen fullerenen waren giftiger in vergelijking met negatief geladen fullerenen [128]. Onderzoek toont aan dat in water oplosbare fullerenen het vermogen hebben om te beschermen tegen celdood door te werken als opruimers van vrije radicalen [129, 183]. Recent onderzoek is gedaan bij zebravissen met nano-uien die multi-shell fullereenstructuren zijn. Ze vertonen een lage toxiciteit en een goede biocompatibiliteit in de zebravislarven [184]. Koolstofnanobuisjes (CNT's) hebben verschillende fysisch-chemische kenmerken waarvoor ze een aantrekkelijke manier van medicijnafgifte zijn voor onderzoekers [176, 185, 186]. De efficiëntie van CNT's hangt af van hun lengte en de aard van hun muren, of ze nu enkel- of meerwandig zijn. Rapporten suggereren dat enkel- of meerwandige ongerepte CNT's een minimale impact hebben op de groei en ontwikkeling van de zebravislarven [187]. Variaties in de lengte van de CNT's kunnen leiden tot veranderingen op moleculair niveau, waarbij langere CNT's cytotoxischer zijn [188]. Volwassen zebravissen bleken bij blootstelling aan meerwandige CNT's toxiciteit te vertonen, waaronder inflammatoire kieuwen [189] en accumulatie van de CNT's in de hersenen en geslachtsklieren [105, 190]. Een andere vorm van op koolstof gebaseerde NP's zijn de quantum dots (QD's) en grafeen quantum dots (GQD's). Het typische kenmerk van de QD's zijn quasi-sferische koolstofstructuren met een diameter van minder dan 10 nm [191] en die van GQD's is kleiner dan 30 nm [192, 193]. Een bijkomend kenmerk van de QD's is hun unieke fotostabiliteit, waardoor ze kunnen worden gecombineerd met de fluoroforen, waardoor een reeks bio-imaging-mogelijkheden wordt geopend [194]. QD's vertonen de minste toxiciteit omdat ze voornamelijk zijn samengesteld uit inerte koolstofmoleculen [195]. Daarom maakt een combinatie van fluorluminescentie en lage toxiciteitseigenschappen het een zeer aantrekkelijk hulpmiddel voor medicijnafgifte [195.196.197].
Nanodeeltjes gericht op het afleveren van medicijnen aan de hersenen
Met de achtergrondkennis over de werking van nanodeeltjes op de fysiologie van zebravissen, proberen onderzoekers nu medicijnen aan de hersenen te leveren via nanotechnologie met behulp van de zebravismodellen Tabel 2. Qian et al. hebben polymeernanodeeltjes gerapporteerd die zijn geconjugeerd met tags van fenylboorzuur op hun oppervlak, wat helpt bij het detecteren van fluorescentie voor de neurotransmitter dopamine met behulp van zebravislarven [91]. Deze bevinding maakt de weg vrij voor theranostica van dopamine-gerelateerde ziekten. Een recent rapport ging echter dieper in op de toxiciteit van het gouden nanodeeltje in vergelijking met ionisch goud in zebravissen die werden onderworpen aan verrijkt sediment [64]. Ze rapporteerden dat het nanodeeltje de neurotransmissie in de hersenen van de zebravis veranderde omdat het een effect had op de acetylcholine-esterase-activiteit. In een interessant werk Sivaji et al. [198] was gericht op het leveren van donepezil, een bekend medicijn voor de ziekte van Alzheimer, via gefunctionaliseerd poly N -isopropyl acrylamide nanogels PNIPAM nanogel naar de hersenen. Ze meldden dat de gel de BBB kon overwinnen en toonden ook aanhoudende afgifte van geneesmiddelen met behulp van het zebravismodel. Deze studie brengt daarom de ontwikkeling van neurospecifieke nanogel voor gerichte medicijnafgifte aan de hersenen naar voren. Dezelfde groep rapporteerde verder de synthese van colloïdaal gouden nanodeeltjes gefunctionaliseerd met polysorbaat 80 en polyethyleenglycol, met mogelijkheden om de bloed-hersenbarrière te overwinnen voor therapeutische doeleinden [199]. In deze studie hebben ze een biocompatibele nanodrager gesynthetiseerd en gevalideerd met het vermogen om de bloed-hersenbarrière te passeren en neurospecifieke medicijnen efficiënt af te leveren.
Translationele benadering van neurospecifieke nanodeeltjes:zebravis naar mensen
A variety of model organisms have been employed till date to investigate human diseases. While chimpanzees and monkeys have a high degree of similarity with humans, mice and rats have been used extensively over the past few decades. Research using zebrafish models to study various human diseases is now on the increase [31]. Various state-of-the-art technologies have been analysed and evaluated using the zebrafish model. In this context, nanodiamonds (ND) which refer to a newer class of nanoparticles belonging to the carbon family are being explored in the latest techniques for drug delivery across the BBB [200, 201]. They possess outstanding optical properties, malleability of surface structures and mechanical properties which are pertinent for targeted drug delivery. The zebrafish has proved to be an apt model system to study the fluorescent nanodiamonds (FND) in detail. Chang et al. have studied the photostability and non-toxicity of FNDs by single particle tracking using zebrafish yolk cells [202]. Further, evaluation of ND to facilitate their application as nanolabels has been performed using laser confocal microscopy and real-time fluorescence tagging in zebrafish [203]. Zebrafish model can hence be explored to assess the potential of NDs as nanolabelling systems to deliver neurospecific drugs. The use of zebrafish is validated by its high genetic and systems similarity with that of humans. Regenerative ability of zebrafish is also a very interesting aspect of its physiology which has made it an important model organism to study neurodegenerative diseases. Recent studies have identified pivotal insights into brain drug delivery mechanism using zebrafish models of neurodegenerative diseases. Recent research conducted regarding drug delivery in the brain using the zebrafish model has revealed pivotal insights about the dynamics of this mechanism. The only drawback withholding accelerated research in this arena is the lack of established protocols to validate the studies. However, it is only a matter of time when such protocols are developed through ongoing research in this field. A great deal of scope still exists for further research on the following focus areas.
-
Admixture of nanoparticles along with two or more drugs to provide better holistic treatment
-
Analysis of fullerenes, nano-onions and nanodiamonds in neurodegenerative diseases
-
Understanding the biocompatibility of the newer nanoparticles and their brain-penetrating ability.
All the above-mentioned focus areas can be easily assessed using zebrafish model systems. The zebrafish model, therefore, holds great promise for development and evaluation of novel techniques for targeted drug delivery within the brain for translational analysis (Fig. 2). This could open up exciting new vistas for medical intervention to develop therapeutic strategies to treat neurodegenerative diseases.
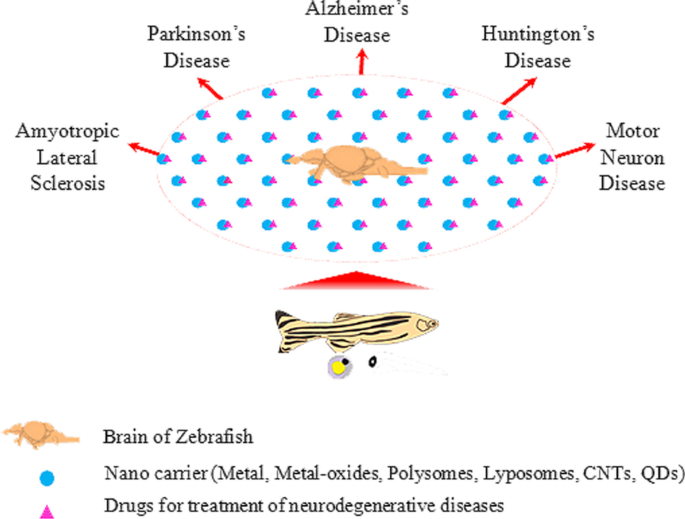
Schematic representation of zebrafish model for delivering drugs encapsulated in nanoparticles to the brain. This method ensures efficient delivery of drugs across the blood–brain barrier (BBB). Several nanoparticles possess the potential to treat a variety of neurodegenerative diseases like Alzheimer’s disease (AD), Parkinson’s disease (PD), Huntington’s disease (HD), amyotrophic lateral sclerosis (ALS) and motor neuron diseases (MND)
Future Research Directions
The last decade witnessed a surge in the use of nanotechnology for brain drug delivery unfolding several exciting new strategies in this arena [16, 17, 204, 205]. However, problems like toxicity, immunogenicity and efficient drug delivery still persist and have restrained the research community from achieving their ultimate goal [206,207,208,209]. Future research prospects for neurospecific drug delivery therefore involve overcoming the existing challenges in this field. Research on nanomaterial toxicity and side effects should be extensive, accurate and always preceed the in vivo implementation of any new nanocarrier formulation. Proper comprehensive analysis of the nano-bio-interactions is absolutely essential for developing strategies for neurospecific drug delivery [210]. Newer imaging techniques should be adopted to broaden the understanding of bio distribution and pharmacokinetics of the delivered drug. Complete knowledge on the bio availability and clearance of the drug is indispensable for achieving the translation from bench side to bed side. Zebrafish, long considered as a “gold standard” for studying several developmental and metabolic diseases, is highly prospective for studies on nanodrug delivery. The transparent embryonic development with the ability to facilitate large-scale drug screening in a vertebrate model among other innumerable key attributes of the zebrafish holds promise for overcoming these roadblocks. The use of this robust model system therefore has immense potential for further research in nanotherapeutics to achieve safe and successful neurospecific drug delivery.
Conclusion
The BBB poses as the main obstacle in delivering drugs to the brain. The physiological function of the BBB is to protect the brain from foreign substances and in doing so it acts as a hurdle even for therapeutic purpose. The current need of the hour is a strategy in drug delivery which is able to overcome the BBB. Only then can effective treatments for brain specific diseases be possible. Recent focus on nanotechnology-based approaches for drug delivery across the BBB seems to have promising prospects for the field of neurospecific drug delivery in the future. Research towards this end is ongoing using a variety of nanoparticles like liposomes, dendrimers, micelles and carbon nanotubes as nanocarriers and nanogels. The zebrafish model is a favourite when it comes to nanotechnology-based toxicity studies and neurospecific drug delivery. Further research on nanotechnology using this model is needed for newer insights which can lead to possible breakthroughs in discovery in neurospecific drug delivery.
Beschikbaarheid van gegevens en materialen
Niet van toepassing.
Afkortingen
- BBB:
-
Blood–brain barrier
- NPs:
-
Nanoparticles
- Au:
-
Gold
- Ag:
-
Silver
- Cu:
-
Copper
- Cd:
-
Cadmium
- CuO:
-
Copper oxide
- MgO:
-
Magnesium oxide
- NiO:
-
Nickel oxide
- ZnO:
-
Zinc oxide
- MPs:
-
Microplastics
- MOFs:
-
Metal organic frameworks
- CNTs:
-
Carbon nanotubes
- TiO2 :
-
Titanium dioxide
- QDs:
-
Quantum dots
- PCR:
-
Polymerase chain reaction
- GQDs:
-
Graphene quantum dots
- PNIPAM:
-
Poly N -isopropyl acrylamide
- NDs:
-
Nanodiamonds
- FND:
-
Fluorescent nanodiamonds
- AD:
-
Disease
- PD:
-
Parkinson’s disease
- HD:
-
Huntington’s disease
- ALS:
-
Amyotrophic lateral sclerosis
- MND:
-
Motor neuron diseases
Nanomaterialen
- Realtime kwaliteitscontrole:welk systeem is geschikt voor u?
- Bewezen real-time locatiesysteem (RTLS) voor de gezondheidszorg
- Nanovezels en filamenten voor verbeterde medicijnafgifte
- Omgevingsgevoelige metaal-organische raamwerken als medicijnafgiftesysteem voor tumortherapie
- Op cellen gebaseerde medicijnafgifte voor kankertoepassingen
- 131I-getraceerde PLGA-lipide nanodeeltjes als dragers van medicijnafgifte voor de gerichte chemotherapiebehandeling van melanoom
- Nanotechnologie:van in vivo beeldvormingssysteem tot gecontroleerde medicijnafgifte
- Nucleoside-lipide-gebaseerde nanocarriers voor toediening van sorafenib
- Onderzoek naar fysisch-chemische kenmerken van een op nanoliposoom gebaseerd systeem voor dubbele toediening van geneesmiddelen
- Een opkomende rol voor IoT in het gezondheidszorgsysteem
- 3D-geprinte microrobots houden belofte voor medicijnafgifte



