Elektrochemische reductie van CO2 op holle kubieke Cu2O@Au Nanocomposieten
Abstract
Zonder oppervlakteactieve stoffen en lage Au-lading Cu2 O@Au en Au holle kubussen, op basis van elektrolytisch afgezet Cu2 O-kubussen als opgeofferde templates werden bereid door middel van een galvanische vervangingsreactie (GRR). De elektrokatalytische prestatie van de bereide katalysatoren ten opzichte van koolstofdioxide (CO2 ) elektrochemische reductie werd geëvalueerd. De experimentele resultaten laten zien dat Cu2 O@Au-katalysator kan CO2 . omzetten tot koolmonoxide (CO) met een maximale Faraday-efficiëntie (FE) van ~ 30,1% bij een potentiaal van -1,0 V (vs. RHE) en is ongeveer tweemaal de FE van de andere katalysatoren bij dezelfde potentiaal. Ter vergelijking:een dergelijke elektrokatalytische verbetering wordt toegeschreven aan het metaaloxide-interface in Cu2 O@Au.
Achtergrond
CO2 wordt beschouwd als het belangrijkste broeikasgas dat bijdraagt aan de opwarming van de aarde; daarom een effectieve manier vinden om CO2 . om te zetten/op te slaan heeft steeds meer aandacht getrokken [1, 2]. De belangrijkste methoden voor het verminderen van CO2 concentratie in de atmosfeer omvat CO2 afvangen en ondergronds opslaan [3, 4] of omzetten in chemicaliën met toegevoegde waarde [5,6,7]. Vanwege de stabiele chemische eigenschappen van CO2 , is het noodzakelijk om hoge temperatuur, hoge druk of katalysator te gebruiken om het reactief te maken. Gezien de energie- en zuinigheidskosten, elektrochemische conversie van CO2 onder milde omstandigheden is een veelbelovende strategie om het overtollige broeikasgas te verminderen en een kunstmatige koolstofkringloop te bereiken [8,9,10]. De grootste problemen in CO2 elektrochemische reductie zijn de intrinsieke stabiliteit van CO2 , het lagere potentieel van CO2 reductiereactie (CO2 RR), en de lage selectiviteit voor reductieproducten [11]. Het is dus dringend nodig om CO2 . te ontwikkelen reductiekatalysatoren met hoge selectiviteit, goede stabiliteit en uitstekende activiteit.
Eerdere studies tonen aan dat verschillende metalen elektroden, zoals Au, Ag, Cu, Pd en Sn, aantrekkelijke kandidaten zijn voor CO2 RR [12]. Onder hen is koper de enige metaalkatalysator die aanzienlijke C1-C3-koolwaterstofproducten en alcoholen produceert [13]. Au, een zeer actieve katalysator voor CO2 elektrochemische reductie, kan CO produceren uit CO2 met hoge selectiviteit en lage overpotentiaal [11]. Met uitzondering van Cu en Au, zetten de andere metaalelektroden, waaronder Ag, Pd en Sn, voornamelijk CO2 om. naar CO of formatteren (HCOO − ) via een twee-elektronenoverdrachtsroute [14,15,16,17]. Aan de ene kant is het echter moeilijk om de selectiviteit en stabiliteit van op Cu gebaseerde katalysatoren te verbeteren voor de elektrochemische reductie van CO2 tot C1-C3-koolwaterstofproducten. Aan de andere kant is Au zeer selectief voor CO-productie, maar de hoge kosten en de overvloed aan zeldzame aarde belemmeren de industrialisatie in CO2 RR [18, 19]. De composieten op basis van koper en goud hebben een groot potentieel voor CO2 elektrochemische reductie. Maar de meeste van de momenteel gerapporteerde CuAu-katalysatoren werden gesynthetiseerd via de solvothermische methode [20]. De morfologie van de nanodeeltjes is moeilijk te controleren, en deze deeltjes hebben de neiging om gemakkelijk te oxideren en te aggregeren [21, 22]. Daarom is het erg belangrijk om een soort goud- en kopercomposiet te ontwikkelen met een controleerbare morfologie, hoge stabiliteit en hoge productselectiviteit voor CO2 elektrochemische reductie. Bovendien is gemeld dat het metaaloxide-grensvlak de elektrokatalytische activiteit van de katalysatoren ten opzichte van CO2 zou kunnen verbeteren. RR [23].
Hier in dit artikel rapporteren we een oppervlakteactieve stofvrije Cu2 O@Au nanocomposiet waarin Cu2 O/Au-interface werd geconstrueerd voor elektrokatalytische reductie van CO2 in water. Ter vergelijking werden de holle kubische Au-katalysatoren bereid door Cu2 . op te lossen O in Cu2 O@Au-katalysatoren in ammoniak. De experimentele resultaten toonden aan dat het metaal/oxide-grensvlak in Cu2 O@Au-katalysator kan inert CO2 . activeren molecuul en verhoog de FE van CO. De CO FE is 30,1% op Cu2 O@Au-elektrode bij -1,0 V (vs. RHE) wat twee keer zo groot is als die op Cu2 O- en Au-elektroden bereid in dit werk. Dit resultaat bewees niet alleen dat het metaaloxide-interface de elektrokatalytische activiteit van de elektroden naar CO2 zou kunnen verbeteren RR, maar maakte ook de weg vrij voor de synthese van metaaloxidekatalysatoren.
Methoden
Materialen
Koper (II) trifluoracetaat (Cu (TFA)2 , 98%), kaliumtrifluoracetaat (KTFA, 98%) en chloorgoudzuur (HAuCl4 , 99,9%) werden gekocht bij Sigma-Aldrich en direct zonder enige zuivering gebruikt. Alle oplossingen werden bereid met Milli-Q ultrapuur water (Millipore 18,2 MΩ cm). Stikstof (N2 ) (99,999%) en CO2 (99,999%) gassen die in het experiment werden gebruikt, werden gekocht bij Foshan MS Messer Gas CO., Ltd. Carbonpapier met een dikte van 0,3 mm werd gekocht bij Hesen in Shanghai.
Voorbereiding van Cu2 O Nanocubes en Cu2 O@Au
Cu2 O-nanokubussen werden gesynthetiseerd volgens de methode die in eerdere literatuur is beschreven [24]. De kubieke Cu2 O nanodeeltjes werden elektrolytisch afgezet op een carbonpapier (1 cm × 1 cm) met behulp van chronoamperometrie bij − 0.06 V (vs. SCE) gedurende 1 h in 10 mM Cu (TFA)2 en 0,2 M KTFA-oplossing. Voor de Cu2 O nanocubes elektrodepositie, het carbonpapier werd meerdere keren gewassen met water en ethanol.
De bereiding van Cu2 O@Au composiet dompelde Cu2 . onder O kubussen in 2 mL HAuCl4 (1 mM) oplossing gedurende 30 min bij 277 K.
Voorbereiding van Hollow Cubic Au
De kant-en-klare Cu2 O@Au-composiet werd ondergedompeld in 2 M ammoniakwater gedurende 12 u bij 277 K om Cu2 te verwijderen O en bewaar holle kubieke Au op het carbonpapier.
Karakterisering
De morfologieën en structuren van nanomaterialen werden gekarakteriseerd door scanning elektronenmicroscopie (SEM, JEOL-6701F) uitgerust met een energiedispersief röntgenstraling (EDX) detectorsysteem. De röntgendiffractie (XRD) patronen werden geregistreerd met behulp van Rigaku Ultima IV röntgendiffractometer met Cu Kα-straling (λ = 1.5406 Å) om de samenstelling van de producten te bestuderen.
Elektrochemische metingen van CO2
Elektrochemische metingen werden uitgevoerd met een CH Instruments 760D (Chenhua, Shanghai) en een systeem met drie elektroden. De CO2 elektrochemische reductie werd uitgevoerd in een H-type cel met twee compartimenten met een Ag/AgCl en een platinavel (1 cm × 1 cm) die respectievelijk als referentie- en tegenelektroden werden gebruikt. Compensatie voor 85% iR-daling werd gebruikt in CO2 elektrochemische reductie. In dit werk zijn alle potentiëlen gerapporteerd in de CO2 elektrochemische reductie werden vergeleken met de omkeerbare waterstofelektrode (RHE). De RHE gebruikte de volgende conversie:E RHE (V) = E Ag/AgCl (V) + 0.197 V + (0.059 V × pH) [25]. Een schematische schets van de H-type elektrochemische cel wordt getoond in Fig. 1. De twee elektrochemische cellen werden gescheiden door een protonenuitwisselingsmembraan (Nafion 117, Sigma-Aldrich).
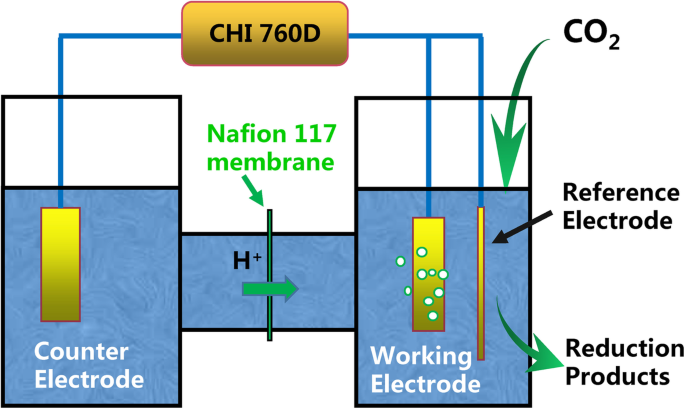
Een schematische schets van de elektrochemische cel van het H-type
Lineaire sweep-voltammetrie-experimenten (LSV) werden uitgevoerd in 0,1 M KHCO3 oplossing onder N2 (99,999%) of CO2 (99,999%) sfeer. Voorafgaand aan LSV-tests, N2 of CO2 werden respectievelijk 20 min in de oplossing in een elektrochemische cel van het H-type gespoeld.
Voor CO2 RR-experimenten, de elektrolytoplossing werd gedurende 20 min verzadigd met CO2 en de pH van de 0,1 M KHCO3 oplossing was ongeveer 8,6. De CO2 elektrochemische reductie werd uitgevoerd onder potentiostatische omstandigheden terwijl de stroom- en productconcentratie werden gevolgd. De bereide materialen werden gebruikt als werkelektroden. De CO2 RR-experimenten werden driemaal herhaald bij elke potentiaal. Detectie van CO2 reductieproducten werden gebruikt door een online gaschromatografie (GC Agilent, 7890B). Elke 930 s werd een GC-run uitgevoerd. De GC was uitgerust met twee Plot-Q-kolommen, een thermische geleidbaarheidsdetector (TCD), een vlamionisatiedetector (FID) en een demethanizer met N2 (99,999%) als draaggas. De inhoud van vloeibare producten werd in dit werk verwaarloosd. Tijdens de CO2 RR-experimenten, CO2 werd geventileerd in de kathode-elektrolysecel met een stroomsnelheid van 20 ml min −1 continu.
$$ {i}_x=\frac{C_x\cdot q\cdot p}{RT}\cdot {n}_xF $$ (1) $$ \mathrm{FE}\left(\%\right)=\frac {i_x}{i_{total}}\cdot 100 $$ (2)De FE-berekeningsvergelijking wordt weergegeven in Vgl. 1 en 2, waarin i totaal is de stroomdichtheid geregistreerd door de potentiostaat tijdens CO2 RR [26]. De gedeeltelijke stroom (i x ) die nodig is om elk product te genereren (x = H2 , CO, CH4 , C2 H4 ) is afgeleid van Vgl. 1. C x wordt geëxtraheerd uit de kalibratiecurve GC-volumeconcentratie van product x . n x is het aantal gereduceerde elektronen dat nodig is om x . te produceren van koolstofdioxidemoleculen. q is de gasstroomsnelheid, p is constante druk, en T is de kamertemperatuur. R is de gasconstante, en F is de constante van Farada.
Resultaten en discussie
Morfologie
De morfologieën en structuren van het voorbereide Cu2 O en Cu2 O@Au nanocubes gekenmerkt door SEM werden getoond in Fig. 2. De Cu2 O nanokubussen die elektrolytisch op het carbonpapier waren afgezet, hadden regelmatige vormen en een glad oppervlak (figuur 2a). De gemiddelde randlengte van de Cu2 O-kubussen waren ongeveer 1 m, zoals weergegeven in figuur 2b. Een gepaste reactietijd en Au 3+ oplossingsconcentratie van GRR op Cu2 O nanodeeltjes zouden Cu2 . produceren O@Au nanostructuren zoals weergegeven in Fig. 2c en d.

De SEM-afbeeldingen van Cu2 O nanokubussen (a , b ), Cu2 O@Au nanodeeltjes (c , d ), en EDX van Cu2 O@Au nanodeeltjes (e , v )
Na Cu2 O nanokubussen werden ondergedompeld in HAuCl4 (1 mM) oplossing voor 30 min, de oppervlakteverdeling van Au en Cu van Cu2 O@Au-composieten werden onderzocht door EDX-mapping getoond in Fig. 2e en f. Het toonde aan dat Au-nanodeeltjes uniform verdeeld waren over de Cu2 O nanokubus oppervlak. De GRR tussen Cu2 O en HAuCl4 omvat de evolutie van een interne holle kern en oppervlakteprecipitatie van Au-nanodeeltjes [27, 28].
Zoals weergegeven in Afb. 3, Cu2 O in Cu2 O@Au-composieten werden verwijderd en de achtergebleven Au-nanodeeltjes erven het kubieke frame van de Cu2 O@Au composieten, na Cu2 O@Au nanocubes werden 12 uur ondergedompeld in ammoniakwater. De kleine Au-nanodeeltjes in een hol kubisch Au-raamwerk hadden een diameter van ongeveer 20 ~ 30 nm.

De SEM-afbeeldingen van holle kubieke Au (a –c ) met verschillende vergroting
XRD-analyse
De kristalstructuur van de bereide katalysatoren werd onderzocht met XRD en de diffractiepatronen werden getoond in Fig. 4. De diffractiepiek bij 2θ = 54,51° behoort tot het carbonpapier. De diffractie piekt bij 2θ = 36.46, 42.36, 61.44 en 73.55° worden toegeschreven aan respectievelijk de (111), (200), (220) en (311) van de Cu2 O kubus (JCPDS 78-2076). Vier zwakke pieken bij 2θ = 38.18, 44.39, 64.57 en 77.54° zijn toegewezen aan respectievelijk (111), (200), (220) en (311), van Au (JCPDS 04-0784) die Cu2 verving O op het carbonpapier. Het grootste deel van Cu2 O werden vervangen door Au; dus kwamen de diffractiepieken overeen met Cu2 O verdween in XRD-patroon van holle kubieke Au.
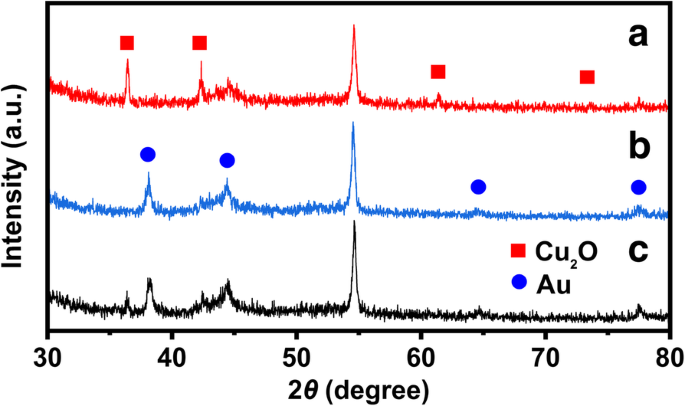
XRD-patronen van (a) Cu2 O kubus, (b) holle kubieke Au, en (c) Cu2 O@Au
CO2 Elektrochemische reductieprestaties
De LSV-curven van Cu2 O kubus, Cu2 O@Au en holle kubische Au-elektroden worden getoond in Fig. 5. De LSV-experimentele toestand werd verkregen bij een kathodische veegsnelheid van 50 mV s −1 met N2 -verzadigd of CO2 -verzadigd 0,1 M KHCO3 oplossing. De stroomdichtheid van alle drie de monsters onder de N2 atmosfeer is hoger dan die onder CO2; dit verschil kan worden veroorzaakt door de waterstofevolutiereactie (HER) op Cu2 O kubus, Cu2 O@Au en holle kubische Au, d.w.z. met continue stroom van CO2 in de kathodische elektrolytische cel wordt het oppervlak van de elektrode bedekt door geadsorbeerde CO-moleculen die de HER op het elektrode-oppervlak remmen en de reductiestroom verminderen [29]. De stroomdichtheid van Cu2 O@Au-elektrode in CO2 -verzadigd 0,1 M KHCO3 oplossing is hoger dan Cu2 O en holle kubische Au-elektroden zoals weergegeven in Fig. 5d.
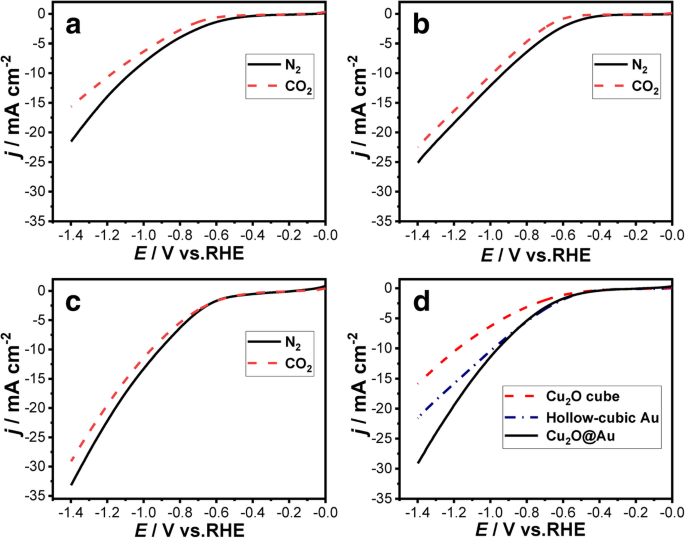
LSV-curven verkregen op a Cu2 O kubus, b holle kubieke Au, en c Cu2 O@Au-elektroden in N2 -verzadigd (zwarte ononderbroken lijn) en CO2 -verzadigd (rode stippellijn) 0,1 M KHCO3 oplossingen. d LSV-curves van de drie monsters in CO2 -purged 0.1 M KHCO3 oplossingen
De elektrochemische methode van amperometrische i –t werd gebruikt om de prestaties van CO2 . te evalueren RR in 0,1 M KHCO3 oplossing bij kamertemperatuur onder atmosferische druk. De potentialen worden ingesteld tussen − 0,7 en − 1,2 V voor latere productbepaling. Bij verschillende potentialen is de FE van H2 en CO voor CO2 RR op Cu2 O-kubussen hebben een significant verschil, zoals weergegeven in figuur 6a, d.w.z. de FE van H2 neemt af omdat het oppervlak van Cu2 O-kubussen worden bedekt door CO-moleculen geproduceerd door CO2 RR, en de HER wordt geremd [30]. De FE van CH4 en C2 H4 variëren enigszins in verschillende mogelijkheden.
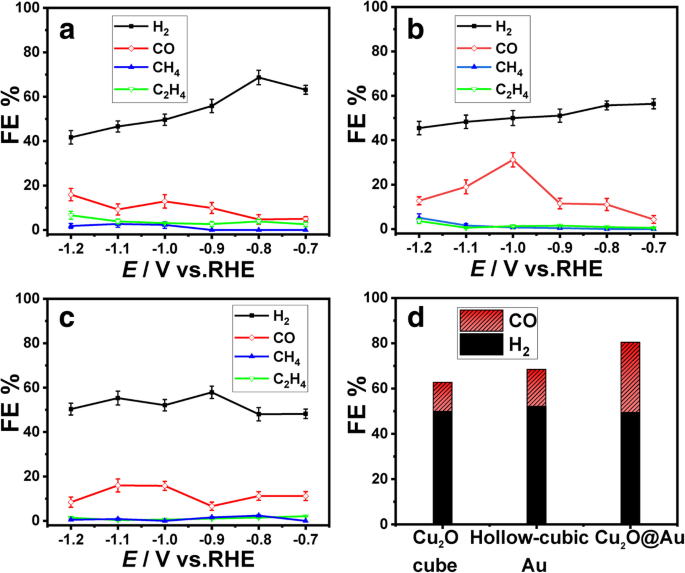
FE van a Cu2 O kubuskatalysator, b Cu2 O@Au-katalysator en c holle kubieke Au-katalysator. d Vergelijking van FE voor CO en H2 bij − 1.0 V vs RHE op drie katalysatoren
De FE van Cu2 O@Au-katalysator wordt getoond in Fig. 6b. De FE van CO blijft opwaartse trend met potentieel afnemende en bereikt een maximum van 30,1%, bij -1,0 V (vs. RHE). De FE van H2 daalt van 56,7 naar 45,6%. Vergeleken met de Cu2 O @ Au-katalysator, de maximale CO FE van holle kubieke Au-katalysator is 16,3% bij -1,0 V (figuur 6c). De CO FE van Cu2 O@Au-katalysator bij -1,0 V is ongeveer tweemaal de holle kubische Au-katalysator bij dezelfde potentiaal. Cu2 O@Au-composiet vertoont superieure katalytische activiteit voor CO2 elektrochemische reductie dan Cu2 O-kubuskatalysator en holle kubische Au-katalysator, en het is gerelateerd aan het grensvlakeffect van metaaloxiden.
Om het reactiemechanisme op CO2 . te begrijpen RR tot CO, we hebben de volgende reactiestappen overwogen:
$$ {\mathrm{CO}}_2\left(\mathrm{g}\right)+\ast +{\mathrm{H}}^{+}\left(\mathrm{aq}\right)+{\ mathrm{e}}^{-}{\to}^{\ast}\mathrm{COOH} $$ (3) $$ {}^{\ast}\mathrm{CO}\mathrm{OH}+{\ mathrm{H}}^{+}\left(\mathrm{aq}\right)+{\mathrm{e}}^{-}{\to}^{\ast}\mathrm{CO}+{\mathrm {H}}_2\mathrm{O}\left(\mathrm{l}\right) $$ (4) $$ {}^{\ast}\mathrm{CO}\to \mathrm{CO}\left( \mathrm{g}\right)+\ast $$ (5)Over het algemeen, vgl. 3 wordt gezien als de potentiële beperkende stap op CO2 RR naar CO [23]. De corresponderende bindingsenergie kan aanzienlijk worden verlaagd op het grensvlak van Cu2 O@Au, vergeleken met de Cu2 O kubus oppervlak of Au oppervlak. Bovendien is de Vgl. 4 en vgl. 5 worden ook gefaciliteerd op de Cu2 O@Au-interface. Het geeft aan dat het grensvlak-effect van metaaloxiden de CO2 . kan versterken adsorptie en het elektrochemische oppervlak [31, 32]. De Cu2 O@Au-katalysator bestaat uit Cu2 O- en Au-nanodeeltjes kunnen een metaaloxide-interface leveren om inert CO2 . te activeren moleculen, verbeteren de efficiëntie van de ladingsoverdracht en verhogen de FE van CO [33].
Vergeleken met het massaoverdrachtseffect van holle kubische Au-katalysatoren samengesteld door Au-nanodeeltjes, zijn de synergetische interacties van metaaloxiden vervaardigd door Cu2 O-kubussen en Au-nanodeeltjes zijn voordeliger om CO2 . om te zetten in CO door CO2 elektrochemische reductie.
De FE-vergelijking voor CO en H2 bij − 1.0 V vs RHE op Cu2 O kubuskatalysator, Cu2 O@Au-katalysator en holle kubieke Au-katalysator worden getoond in Fig. 6d. De H2 /CO-verhouding van deze drie katalysatoren is als volgt:3,9, 3,2 en 1,7. De Cu2 O@Au-katalysatorproductieverhouding van 1,7 door CO2 elektrochemische reductie ligt het dichtst bij die van syngas (het mengsel van CO en H2 ) verhouding van 2 [34, 35]. De katalysatoroppervlakteconstructiemethode en het aandeel productgassen zouden bijdragen aan het ontwerp van zeer selectieve CO2 RR-katalysatoren.
De gemiddelde stroomdichtheid van drie katalysatoren, uitgevoerd door amperometrische i –t , wordt getoond in Fig. 7. Met de potentiële toename vertoont het duidelijk toenemende stroomdichtheden van drie katalysatoren zoals verwacht. Het verschil van de gemiddelde totale stroomdichtheid tussen holle kubieke Au (blauwe ononderbroken lijn) en Cu2 O@Au (zwarte ononderbroken lijn) zet uit bij -1,0 V, maar het verschil van de gemiddelde totale stroomdichtheid tussen holle kubische Au en Cu2 O kubus (rode ononderbroken lijn) is niet gemarkeerd binnen − 0,7 tot − 1,1 V. Bijgevolg kunnen we concluderen dat de efficiëntie van de ladingsoverdracht van Cu2 O@Au-katalysator is hoger dan de andere twee katalysatoren.
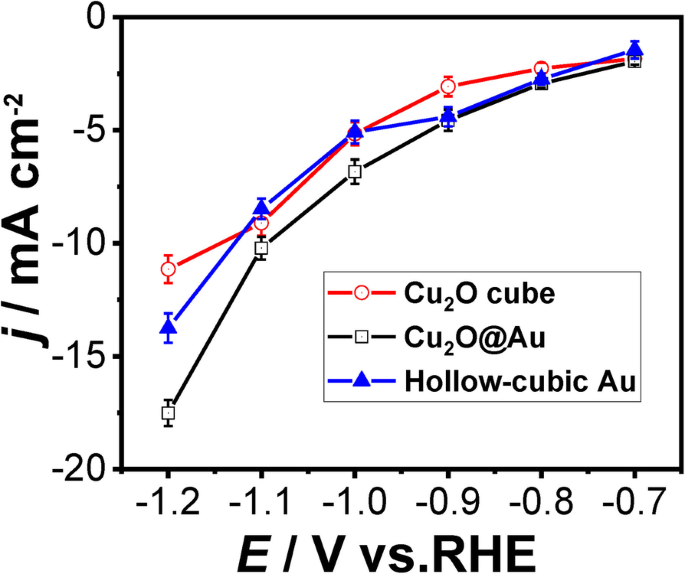
De gemiddelde totale stroomdichtheid van de drie katalysatoren voor CO2 reductie bij verschillende mogelijkheden
Conclusies
Samengevat, surfactant-vrije en lage Au-laadelektroden voor CO2 elektrochemische reductie werden bereid door elektrodepositie en GRR. De Cu2 O@Au-katalysator vertoont superieure katalytische activiteit voor CO2 RR dan Cu2 O-kubussen en holle kubische Au-katalysator vanwege het metaaloxide-interface, d.w.z. het metaaloxide-interface zou de inerte CO2 kunnen activeren moleculen geabsorbeerd op elektroden. Voor Cu2 O@Au-katalysator, het kan CO2 . omzetten tot CO met een maximale FE van ~ 30,1% bij -1,0 V en is ongeveer twee keer zoveel als de andere katalysatoren met dezelfde potentiaal. Het geproduceerde gas van Cu2 O@Au-katalysator door CO2 elektrochemische reductie heeft een H2 /CO-verhouding van 1,7, wat dicht bij de syngasverhouding van het Fischer-Tropsch-proces van 2 ligt. Op basis van deze resultaten kunnen we enkele conclusies trekken dat de Cu2 O@Au-katalysator vervaardigd door Cu2 O-kubussen en Au-nanodeeltjes kunnen een metaal/oxide-interface vormen om inert CO2 . te activeren moleculen en deze katalysator zou kunnen worden toegepast op de productie van syngas door CO2 elektrochemische reductie.
Afkortingen
- CO:
-
Koolmonoxide
- CO2 :
-
Kooldioxide
- CO2 RR:
-
CO2 reductiereactie
- EDX:
-
Energiedispersieve röntgenstraling
- GC:
-
Gaschromatografie
- GRR:
-
Galvanische vervangingsreactie
- HCOO − :
-
Formaat
- HAAR:
-
Reactie waterstofontwikkeling
- LSV:
-
Lineaire sweep-voltammetrie
- N2 :
-
Stikstof
- RHE:
-
Omkeerbare waterstofelektrode
- SEM:
-
Scanning elektronenmicroscopie
- XRD:
-
Röntgendiffractie
Nanomaterialen
- Zirkonia
- Sensirion:geminiaturiseerde CO2-sensor
- Fibre Laser vs CO2 Laser
- Onderzoek naar de sorptie van zware metalen met behulp van nanocomposieten van met ijzer gemodificeerde biochar
- Nieuwe nanocomposieten van polystyreen met polyaniline gedoteerd met laurylzwavelzuur
- Morfologische evolutie van Si(001)-substraten met pitpatroon aangedreven door reductie van oppervlakte-energie
- Een kunstmatige biomimetische katalyse die CO2 omzet in groene brandstoffen
- Is CO2 een schoon middel
- De complexiteit van elektrochemisch slijpen
- Elektrochemisch snijden Voordelen en nadelen
- Gecomprimeerde CO2 versus perslucht



