Afhankelijkheid van de toxiciteit van nanodeeltjes van hun fysische en chemische eigenschappen
Abstract
Studies over de methoden van de synthese van nanodeeltjes (NP), de analyse van hun kenmerken en de verkenning van nieuwe gebieden van hun toepassingen staan in de voorhoede van de moderne nanotechnologie. De mogelijkheid om in water oplosbare NP's te ontwerpen, heeft de weg vrijgemaakt voor hun gebruik in verschillende fundamentele en toegepaste biomedische onderzoeken. Op dit moment worden NP's gebruikt bij de diagnose voor beeldvorming van talrijke moleculaire markers van genetische en auto-immuunziekten, kwaadaardige tumoren en vele andere aandoeningen. NP's worden ook gebruikt voor gerichte afgifte van medicijnen aan weefsels en organen, met controleerbare parameters van medicijnafgifte en accumulatie. Daarnaast zijn er voorbeelden van het gebruik van NP's als actieve componenten, bijvoorbeeld fotosensitizers bij fotodynamische therapie en bij hyperthermische tumorvernietiging door NP-opname en verwarming. Een hoge toxiciteit van NP's voor levende organismen is echter een sterke beperkende factor die hun gebruik in vivo belemmert. Huidige onderzoeken naar toxische effecten van NP's, gericht op het identificeren van de doelen en mechanismen van hun schadelijke effecten, worden uitgevoerd in celcultuurmodellen; studies naar de patronen van transport, accumulatie, afbraak en eliminatie van NP in diermodellen. Deze review systematiseert en vat beschikbare gegevens samen over hoe de mechanismen van NP-toxiciteit voor levende systemen verband houden met hun fysische en chemische eigenschappen.
Achtergrond
De International Organization for Standardization definieert nanodeeltjes (NP's) als structuren waarvan de afmetingen in één, twee of drie dimensies binnen het bereik van 1 tot 100 nm liggen. Afgezien van de grootte, kunnen NP's worden geclassificeerd in termen van hun fysieke parameters, bijvoorbeeld elektrische lading; chemische kenmerken, zoals de samenstelling van de NP-kern of -schil; vorm (buizen, films, staven, enz.); en oorsprong:natuurlijke NP's (NP's in vulkanisch stof, virale deeltjes, enz.) en kunstmatige NP's, die centraal staan in deze review.
Nanodeeltjes worden op grote schaal gebruikt in elektronica, landbouw, textielproductie, medicijnen en vele andere industrieën en wetenschappen. NP-toxiciteit voor levende organismen is echter de belangrijkste factor die het gebruik ervan bij de behandeling en diagnose van ziekten beperkt. Momenteel worden onderzoekers vaak geconfronteerd met het probleem van het evenwicht tussen het positieve therapeutische effect van NP's en bijwerkingen die verband houden met hun toxiciteit. In dit opzicht is de keuze van een adequaat experimenteel model voor het schatten van de toxiciteit tussen in vitro (cellijnen) en in vivo (proefdieren) van het grootste belang. De NP-toxische effecten op individuele celcomponenten en individuele weefsels zijn gemakkelijker te analyseren in in vitro modellen, terwijl in vivo experimenten het mogelijk maken om de NP-toxiciteit voor individuele organen of het lichaam als geheel te schatten. Bovendien hangt het mogelijke toxische effect van NP's af van hun concentratie, duur van hun interactie met levende materie, hun stabiliteit in biologische vloeistoffen en het vermogen tot accumulatie in weefsels en organen. De ontwikkeling van veilige, biocompatibele NP's die kunnen worden gebruikt voor diagnose en behandeling van ziekten bij de mens kan alleen worden gebaseerd op een volledig begrip van de interacties tussen alle factoren en mechanismen die ten grondslag liggen aan NP-toxiciteit.
Medische toepassingen van nanodeeltjes
In de geneeskunde kunnen NP's worden gebruikt voor diagnostische of therapeutische doeleinden. Bij diagnose kunnen ze dienen als fluorescerende labels voor de detectie van biomoleculen en pathogenen en als contrastmiddelen in magnetische resonantie en andere onderzoeken. Bovendien kunnen NP's worden gebruikt voor gerichte afgifte van geneesmiddelen, waaronder eiwitten en polynucleotidestoffen; in fotodynamische therapie en thermische vernietiging van tumoren, en in prothetische reparatie [1,2,3,4,5,6]. Sommige typen NP's worden al met succes in de kliniek gebruikt voor medicijnafgifte en beeldvorming van tumorcellen [7,8,9].
Voorbeelden van het gebruik van gouden NP's stapelen zich de laatste tijd op. Ze hebben bewezen efficiënte dragers te zijn van chemotherapeutica en andere medicijnen. Gouden NP's zijn zeer biocompatibel; hoewel goud als stof inert is ten opzichte van biologische objecten, kan niet worden beweerd dat hetzelfde geldt voor gouden NP's, aangezien er nog geen sluitende gegevens zijn over de afwezigheid van vertraagde toxische effecten [10]. Naast gouden NP's worden die op basis van micellen, liposomen [11] en polymeren met aangehechte "capture molecules" [12] al gebruikt als medicijndragers. Enkel- en meerwandige nanobuisjes zijn goede voorbeelden van NP's die worden gebruikt voor medicijnafgifte. Ze zijn geschikt voor het hechten van verschillende functionele groepen en moleculen voor gerichte levering, en hun unieke vorm stelt ze in staat selectief door biologische barrières te dringen [13]. Het gebruik van NP's als vehikels voor geneesmiddelen verhoogt de specificiteit van de afgifte en vermindert de minimale hoeveelheid NP's die nodig is voor het bereiken en behouden van het therapeutische effect, waardoor de uiteindelijke toxiciteit wordt verminderd. Dit is vooral belangrijk in het geval van zeer giftige en kortlevende chemo- en radiotherapeutische middelen [14].
Quantum dots (QD's) vormen een andere groep NP's met een hoog potentieel voor klinisch gebruik. QD's zijn halfgeleider nanokristallen van 2 tot 10 nm groot. Hun vermogen tot fluorescentie in verschillende spectrale regio's, waaronder de infrarood [15], maakt ze geschikt voor het labelen en afbeelden van cellen, celstructuren of pathogene biologische agentia, evenals verschillende processen in cellen, weefsels en het lichaam als geheel [ 16,17,18], wat belangrijke diagnostische implicaties heeft [19, 20]. NP's op basis van superparamagnetisch ijzeroxide worden efficiënt gebruikt als contrastmiddelen in magnetische resonantietomografie (MRT) voor het afbeelden van lever-, beenmerg- en lymfeklierweefsels [21]. Er is ook een voorbeeld waarbij radioactief gelabelde enkelwandige koolstofnanobuisjes gefunctionaliseerd met fosfolipiden werden gebruikt voor het labelen van integrinebevattende tumoren en hun daaropvolgende detectie door middel van positronemissietomografie in experimenten op muizen [22].
Nanodeeltjes zijn ook gebruikt bij het ontwerpen van biosensoren, waaronder die op basis van koolstofnanobuisjes voor het meten van het glucosegehalte [23], het detecteren van specifieke DNA-fragmenten en regio's [24] en het identificeren van bacteriële cellen [25].
Zilver (of zilverbevattende) NP's oefenen antimicrobiële en cytostatische effecten uit; om deze reden worden ze veel gebruikt in de geneeskunde, bijvoorbeeld voor de behandeling van verbanden, chirurgische instrumenten, prothesen en anticonceptiva [13, 22]. Van zilver NP's is gemeld dat ze dienen als effectieve en veilige conserveringsmiddelen in de cosmetische industrie [26].
NP's kunnen echter nog steeds zeer giftig zijn, zelfs als de veiligheid van het gebruik van veel van hun chemische bestanddelen in de geneeskunde is bewezen. Het toxische effect kan worden veroorzaakt door hun unieke fysische en chemische eigenschappen, die ten grondslag liggen aan specifieke mechanismen van interactie met levende systemen. In het algemeen bepaalt dit het belang van het bestuderen van de oorzaken en mechanismen van het mogelijk toxische effect van NP's.
Mechanismen van toxiciteit van nanodeeltjes
De toxiciteit van NP's wordt grotendeels bepaald door hun fysische en chemische eigenschappen, zoals hun grootte, vorm, specifiek oppervlak, oppervlaktelading, katalytische activiteit en de aan- of afwezigheid van een schil en actieve groepen op het oppervlak.
Door de kleine omvang van NP's kunnen ze door epitheliale en endotheliale barrières doordringen in de lymfe en het bloed om door de bloedbaan en lymfestroom naar verschillende organen en weefsels te worden vervoerd, waaronder de hersenen, het hart, de lever, de nieren, de milt, het beenmerg en zenuwstelsel [27, 28], en ofwel door transcytose-mechanismen in de cellen worden getransporteerd of er eenvoudig door het celmembraan in diffunderen. Nanomaterialen kunnen ook de toegang tot de bloedbaan vergroten door inname [29, 30]. Sommige nanomaterialen kunnen de huid binnendringen [31, 32] en zelfs grotere microdeeltjes kunnen de huid binnendringen wanneer deze wordt gebogen [33]. Nanodeeltjes kunnen vanwege hun kleine formaat extravaseren door het endotheel op ontstekingsplaatsen, epitheel (bijv. Darmkanaal en lever), tumoren of microcapillairen binnendringen [34]. Experimenten die de toxische effecten van NP's op het lichaam modelleren, hebben aangetoond dat NP's trombose veroorzaken door de aggregatie van bloedplaatjes [35], ontsteking van de bovenste en onderste luchtwegen, neurodegeneratieve aandoeningen, beroerte, myocardinfarct en andere aandoeningen [36,37,38] ]. Merk op dat NP's niet alleen organen, weefsels en cellen kunnen binnendringen, maar ook celorganellen, bijvoorbeeld mitochondriën en kernen; dit kan het celmetabolisme drastisch veranderen en DNA-laesies, mutaties en celdood veroorzaken [39].
Het is aangetoond dat de toxiciteit van QD's direct verband houdt met het lekken van vrije ionen van metalen in hun kernen, zoals cadmium, lood en arseen, bij oxidatie door omgevingsfactoren. QD's kunnen worden geabsorbeerd door mitochondriën en morfologische veranderingen en disfunctie van de organellen veroorzaken [40]. Invoer van op cadmium gebaseerde QD's in cellen en vorming van vrije Cd 2+ ionen veroorzaken oxidatieve stress [41, 42].
Recente onderzoeken hebben aangetoond dat contact van longweefsel met NP's met een grootte van ongeveer 50 nm leidt tot perforatie van de membranen van type I alveolaire cellen en de resulterende binnenkomst van de NP's in de cellen. Dit veroorzaakt op zijn beurt celnecrose, zoals blijkt uit de afgifte van lactaatdehydrogenase [43]. Er zijn aanwijzingen dat QD-penetratie de vloeibaarheid van het celmembraan verhoogt [44]. Aan de andere kant kan de vorming van reactieve zuurstofspecies (ROS) geïnduceerd door peroxidatie van membraanlipiden leiden tot verlies van membraanflexibiliteit, wat, naast een abnormaal hoge vloeibaarheid, onvermijdelijk leidt tot celdood.
Interactie van NP's met het cytoskelet kan het ook beschadigen. Bijvoorbeeld TiO2 NP's induceren conformationele veranderingen in tubuline en remmen de polymerisatie ervan [45], wat intracellulair transport, celdeling en celmigratie verstoort. In menselijke endotheelcellen van de navelstrengader (HUVEC's) belemmert beschadiging van het cytoskelet de rijping van coördinatie-adhesieve complexen die het cytoskelet verbinden met de extracellulaire matrix, waardoor de vorming van het vasculaire netwerk wordt verstoord [46].
Bovendien kan de NP-cytotoxiciteit interfereren met celdifferentiatie en eiwitsynthese, evenals pro-inflammatoire genen en synthese van ontstekingsmediatoren activeren. Er moet speciaal worden opgemerkt dat normale beschermende mechanismen geen invloed hebben op NP's; macrofaag opname van grote gePEGyleerde nanodeeltjes is efficiënter dan opname van kleine, wat leidt tot accumulatie van NP's in het lichaam [47]. Van superparamagnetische ijzeroxide-NP's is aangetoond dat ze de osteogene differentiatie van stamcellen verstoren of volledig onderdrukken en de synthese van signaalmoleculen, tumorantigenen, enz. activeren [48, 49]. Bovendien verhoogt de interactie van NP's met de cel de expressie van de genen die verantwoordelijk zijn voor de vorming van lysosomen [50], verstoort het hun functioneren [51] en remt het de eiwitsynthese [52, 53]. Een onderzoek naar de toxische effecten van NP's met verschillende samenstellingen op longepitheelcellen en menselijke tumorcellijnen heeft aangetoond dat NP's de synthese van ontstekingsmediatoren stimuleren, bijvoorbeeld interleukine 8 [54]. Volgens Park, die de expressie van pro-inflammatoire cytokines in vitro en in vivo bestudeerde, worden de expressies van interleukine 1 beta (IL-1β) en tumornecrosefactor alfa (TNFα) versterkt als reactie op silicium NP's [55].
Oxidatie, evenals de werking van verschillende enzymen op de schaal en het oppervlak van NP's, resulteert in hun afbraak en afgifte van vrije radicalen. Naast het toxische effect van vrije radicalen, uitgedrukt als oxidatie en inactivering van enzymen, mutagenese en verstoring van chemische reacties die leiden tot celdood, leidt degradatie van NP's tot wijziging of verlies van hun eigen functionaliteit (bijv. het verlies van het magnetische moment en de veranderingen in het fluorescentiespectrum en transport- of andere functies) [56, 57].
Samengevat zijn de meest voorkomende mechanismen van NP-cytotoxiciteit de volgende:
- 1.
NP's kunnen oxidatie veroorzaken via de vorming van ROS en andere vrije radicalen;
- 2.
NP's kunnen celmembranen beschadigen door ze te perforeren;
- 3.
NP's beschadigen componenten van het cytoskelet, waardoor intracellulair transport en celdeling worden verstoord;
- 4.
NP's verstoren de transcriptie en beschadigen DNA, waardoor de mutagenese wordt versneld;
- 5.
NP's beschadigen mitochondriën en verstoren hun metabolisme, wat leidt tot onbalans in de celenergie;
- 6.
NP's interfereren met de vorming van lysosomen, waardoor autofagie en afbraak van macromoleculen wordt belemmerd en de apoptose wordt geactiveerd;
- 7.
NP's veroorzaken structurele veranderingen in membraaneiwitten en verstoren het transport van stoffen in en uit cellen, inclusief intercellulair transport;
- 8.
NP's activeren de synthese van ontstekingsmediatoren door de normale mechanismen van het celmetabolisme te verstoren, evenals het weefsel- en orgaanmetabolisme (Fig. 1).
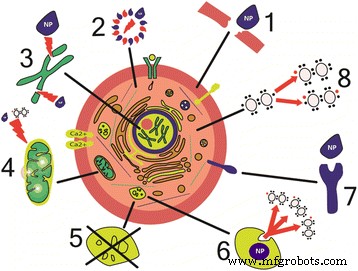
Mechanismen van celbeschadiging door nanodeeltjes. (1) Fysieke schade aan membranen [43, 67, 75]. (2) Structurele veranderingen in cytoskeletcomponenten [45, 46]. (3) Verstoring van transcriptie en oxidatieve schade van DNA [61, 62]. (4) Schade van mitochondriën [39, 40]. (5) Verstoring van het functioneren van lysosoom [51]. (6) Generatie van reactieve zuurstofsoorten [61]. (7) Verstoring van membraaneiwitfuncties [172]. (8) Synthese van ontstekingsfactoren en mediatoren [54, 55]
Hoewel er talrijke mechanismen van NP-toxiciteit zijn, is het noodzakelijk om het type en het mechanisme van elk specifiek toxisch effect van NP's te bepalen en te classificeren als afhankelijk van hun fysische en chemische eigenschappen.
Relaties van toxiciteit van nanodeeltjes met hun fysische en chemische eigenschappen
De toxiciteit van NP's wordt geacht af te hangen van hun fysische en chemische eigenschappen, waaronder de grootte, vorm, oppervlaktelading, chemische samenstelling van de kern en schil, en stabiliteit. In het bijzonder analyseerden Oh et al., met behulp van de data-meta-analyse van 307 artikelen die 1741 cellevensvatbaarheid-gerelateerde datamonsters beschrijven, onlangs de CdSe-quantumdot-toxiciteit. Er is aangetoond dat de QD-nanotoxiciteit nauw gecorreleerd is met hun oppervlakte-eigenschappen (inclusief schaal-, ligand- en oppervlaktemodificaties), diameter, het gebruikte type toxiciteitstest en de blootstellingstijd [58]. Welke van deze factoren het belangrijkst is, wordt bepaald door de specifieke experimentele taak en het specifieke model; daarom zullen we nu elke factor afzonderlijk bekijken.
Nanodeeltjesgrootte en toxiciteit
De grootte en het oppervlak van het NP spelen een belangrijke rol en bepalen grotendeels het unieke mechanisme van NP-interactie met levende systemen. NP's worden gekenmerkt door een zeer groot specifiek oppervlak, wat hun hoge reactiecapaciteit en katalytische activiteit bepaalt. De afmetingen van NP's (van 1 tot 100 nm) zijn vergelijkbaar met de grootte van eiwitbolletjes (2-10 nm), diameter van DNA-helix (2 nm) en dikte van celmembranen (10 nm), waardoor ze gemakkelijk cellen en celorganellen binnendringen. Huo et al. hebben aangetoond dat gouden NP's die niet groter zijn dan 6 nm effectief de celkern binnendringen, terwijl grote NP's (10 of 16 nm) alleen door het celmembraan dringen en alleen in het cytoplasma worden gevonden. Dit betekent dat NP's van enkele nanometers giftiger zijn dan 10 nm of grotere NP's, die de kern niet kunnen binnendringen [59]. Pan et al. hebben de afhankelijkheid van de toxiciteit van gouden NP's van hun grootte in het bereik van 0,8 tot 15 nm getraceerd. De NP's met een grootte van 15 nm bleken 60 keer minder toxisch te zijn dan 1,4 nm NP's voor fibroblasten, epitheelcellen, macrofagen en melanoomcellen. Het is ook opmerkelijk dat 1,4-nm NP's celnecrose veroorzaken (binnen 12 uur na hun toevoeging aan het celkweekmedium), terwijl 1,2-nm NP's voornamelijk apoptose veroorzaken [60]. Deze gegevens suggereren niet alleen dat NP's de kern kunnen binnendringen, maar ook dat de overeenkomst van de geometrische grootte van NP's (1,4 nm) met die van de belangrijkste groef van DNA hen in staat stelt om effectief te interageren met de negatief geladen suiker-fosfaat-DNA-ruggengraat en blokkeer de transcriptie [61, 62].
Bovendien bepaalt de NP-grootte grotendeels hoe de NP's interageren met de transport- en verdedigingssystemen van cellen en het lichaam. Deze interactie beïnvloedt op zijn beurt de kinetiek van hun distributie en accumulatie in het lichaam. Het overzichtsartikel van [63] presenteert zowel theoretische overwegingen als talrijke experimentele gegevens die aantonen dat NP's kleiner dan 5 nm gewoonlijk celbarrières niet-specifiek overwinnen, bijvoorbeeld via translocatie, terwijl grotere deeltjes de cellen binnenkomen door fagocytose, macropinocytose en specifieke en niet-specifieke transportmechanismen . Aangenomen wordt dat een NP-grootte van ongeveer 25 nm optimaal is voor pinocytose, hoewel dit ook sterk afhankelijk is van de celgrootte en het type [63, 64]. In vivo-experimenten hebben aangetoond dat NP's kleiner dan 10 nm snel worden verdeeld over alle organen en weefsels na intraveneuze toediening, terwijl de meeste grotere NP's (50-250 nm) worden gevonden in de lever, milt en bloed [65]. Dit suggereert dat grote NP's worden herkend door specifieke afweersystemen van het lichaam en worden geabsorbeerd door het systeem van mononucleaire fagocyten, wat voorkomt dat ze andere weefsels binnendringen. Bovendien, Talamini et al. beweerde dat de grootte en vorm van de NP de kinetiek van accumulatie en uitscheiding van gouden NP's in filterorganen beïnvloeden, en dat alleen sterachtige gouden NP's zich in de long kunnen ophopen. Ze hebben ook aangetoond dat de veranderingen in de NP-geometrie de NP-passage van de bloed-hersenbarrière niet verbeteren [66].
Het grote specifieke oppervlak zorgt voor een effectieve adsorptie van NP's op het celoppervlak. Dit werd aangetoond in een onderzoek naar de hemolytische activiteit van mesoporeuze siliciumdeeltjes van 100 tot 600 nm ten opzichte van menselijke erytrocyten [67]. De deeltjes met een grootte van 100 nm werden effectief geadsorbeerd op het erytrocytenoppervlak zonder celvernietiging of morfologische veranderingen in de cellen te veroorzaken, terwijl deeltjes van 600 nm het membraan vervormden en de cellen binnendrongen, wat resulteerde in vernietiging van erytrocyten (hemolyse) [67].
Nanodeeltjesvorm en toxiciteit
De karakteristieke vormen van NP's zijn bollen, ellipsoïden, cilinders, platen, kubussen en staven. NP-toxiciteit is sterk afhankelijk van hun vorm. Dit is aangetoond voor talrijke NP's met verschillende vormen en chemische samenstellingen [68,69,70,71]. Sferische NP's zijn bijvoorbeeld meer vatbaar voor endocytose dan nanobuisjes en nanovezels [72]. Er is gevonden dat enkelwandige koolstofnanobuisjes calciumkanalen effectiever blokkeren in vergelijking met bolvormige fullerenen [73].
Vergelijking van de effecten van hydroxyapatiet NP's met verschillende vormen (naaldachtig, plaatachtig, staafachtig en bolvormig) op gekweekte BEAS-2B-cellen heeft aangetoond dat plaatachtige en naaldachtige NP's de dood veroorzaken van een groter deel van cellen dan bolvormige en staafachtige NP's [74]. Dit wordt gedeeltelijk verklaard door het vermogen van plaatachtige en naaldachtige NP's voor het beschadigen van cellen en weefsel bij direct contact. Hu et al. [75] verkreeg interessante gegevens bij het bestuderen van de schade aan zoogdiercellen door grafeenoxide-nanobladen. De toxiciteit van deze NP's werd bepaald door hun vorm waardoor ze het celmembraan fysiek konden beschadigen. Hun toxiciteit bleek echter af te nemen met een toename van de foetale kalfsserumconcentratie in het kweekmedium. Dit werd verklaard door een hoge capaciteit van grafeenoxide-NP's voor het adsorberen van eiwitmoleculen, die het NP-oppervlak bedekken, waardoor de vorm van de NP's verandert en de beschadiging van celmembranen gedeeltelijk wordt voorkomen [75].
Nanodeeltjes chemische samenstelling en toxiciteit
Hoewel de toxiciteit van NP's sterk afhankelijk is van hun grootte en vorm, mag de invloed van andere factoren, zoals de chemische samenstelling en kristalstructuur van NP's, niet worden verwaarloosd. Vergelijking van de effecten van 20 nm siliciumdioxide (SiO2 ) en zinkoxide (ZnO) NP's op muisfibroblasten heeft aangetoond dat ze verschillen in de mechanismen van toxiciteit. ZnO NP's veroorzaken oxidatieve stress, terwijl SiO2 NP's veranderen de DNA-structuur [76].
De toxiciteit van NP's wordt inderdaad grotendeels bepaald door hun chemische samenstelling. Er is aangetoond dat afbraak van NP's kan optreden, en de mate ervan hangt af van de omgevingsomstandigheden, bijvoorbeeld pH of ionsterkte. De meest voorkomende oorzaak van het toxische effect van interactie van NP's met cellen is lekkage van metaalionen uit de NP-kern. De toxiciteit hangt ook af van de samenstelling van de kern van NP's. Sommige metaalionen, zoals Ag en Cd, zijn namelijk giftig en veroorzaken daardoor schade aan de cellen. Andere metaalionen, zoals Fe en Zn, zijn biologisch bruikbaar, maar bij hoge concentraties kunnen ze cellulaire paden beschadigen en daardoor een hoge toxiciteit veroorzaken. Dit effect kan echter worden verminderd, bijvoorbeeld door NP-kernen te coaten met dikke polymeerschillen, silicalagen of gouden omhulsels in plaats van korte liganden of door niet-toxische verbindingen voor NP-synthese te gebruiken. Aan de andere kant kan de samenstelling van de kern worden gewijzigd door toevoeging van andere metalen. Dit kan resulteren in verbeterde chemische stabiliteit tegen degradatie van NP en lekkage van metaalionen in het lichaam [77].
De toxiciteit van NP's hangt ook af van hun kristalstructuur. De relatie tussen kristalstructuur en toxiciteit is onderzocht met behulp van een menselijke bronchiale epitheelcellijn en titaniumoxide NP's met verschillende soorten kristalroosters. Het is aangetoond dat NP's met een rutielachtige kristalstructuur (prismavormig TiO2 kristallen) oxidatieve schade aan DNA, lipideperoxidatie en vorming van micronuclei veroorzaken, wat wijst op abnormale chromosoomsegregatie tijdens mitose, terwijl NP's met anataasachtige kristalstructuur (octaëdrische TiO2 kristallen) van dezelfde grootte zijn niet-toxisch [78]. Opgemerkt moet worden dat de NP-kristalstructuur kan variëren afhankelijk van de omgeving, bijvoorbeeld bij interactie met water, biologische vloeistoffen of andere dispersiemedia. Er zijn aanwijzingen dat het kristalrooster van ZnS NP's bij contact met water wordt herschikt tot een meer geordende structuur [79].
Nanodeeltjes oppervlaktelading en toxiciteit
De oppervlaktelading van NP's speelt een belangrijke rol in hun toxiciteit, omdat deze grotendeels de interacties van NP's met biologische systemen bepaalt [80, 81].
NP-oppervlakken en hun ladingen kunnen worden gewijzigd door verschillend geladen polymeren te enten. PEG (polyethyleenglycol) of foliumzuur wordt vaak gebruikt om de intracellulaire opname van NP en het vermogen om specifieke cellen te targeten te verbeteren [82]. De synthese van biocompatibele TiO2-nanodeeltjes die functionele NH2- of SH-groepen bevatten, is ook gerapporteerd [83]. Andere stoffen, zoals methotrexaat, polyethyleenimine en dextran, waren ook gebruikt om NP-oppervlakken en hun lading te modificeren [84].
Een hoge toxiciteit van positief geladen NP's wordt verklaard door hun vermogen om gemakkelijk cellen binnen te gaan, in tegenstelling tot negatief geladen en neutrale NP's. Dit wordt verklaard door elektrostatische aantrekking tussen de negatief geladen celmembraanglycoproteïnen en positief geladen NP's. Vergelijking van de cytotoxische effecten van negatief en positief geladen polystyreen-NP's op HeLa- en NIH/3T3-cellen heeft aangetoond dat de laatstgenoemde NP's toxischer zijn. Dit komt niet alleen omdat positief geladen NP's effectiever door het membraan dringen, maar ook omdat ze sterker zijn gebonden aan het negatief geladen DNA, waardoor het beschadigd raakt en als gevolg daarvan de G0/G1-fase van de celcyclus wordt verlengd. Negatief geladen NP's hebben geen effect op de celcyclus [85]. Vergelijkbare resultaten zijn verkregen voor positief en negatief geladen gouden NP's, waarbij positieve NP's in grotere hoeveelheden en sneller door cellen worden geabsorbeerd dan negatieve en giftiger zijn [86].
Positief geladen NP's hebben een verbeterde capaciteit voor opsonisatie, d.w.z. adsorptie van eiwitten die fagocytose vergemakkelijken, inclusief antilichamen en complementcomponenten, uit bloed en biologische vloeistoffen [87]. De geadsorbeerde eiwitten, ook wel de eiwitkroon genoemd, kunnen de oppervlakte-eigenschappen van NP's beïnvloeden. Ze kunnen bijvoorbeeld de oppervlaktelading, aggregatiekenmerken en/of hydrodynamische diameter van NP's veranderen. Bovendien leidt adsorptie van eiwitten op het NP-oppervlak tot hun conformationele veranderingen, die de functionele activiteiten van de geadsorbeerde eiwitten kunnen verminderen of volledig remmen. De eiwitkroon bestaat voornamelijk uit belangrijke serumeiwitten, zoals albumine, fibrinogeen en immunoglobuline G, evenals andere effector-, signaal- en functionele moleculen [88, 89]. Binding aan NP's verandert de eiwitstructuur, wat leidt tot het verlies van hun enzymatische activiteit, verstoring van biologische processen en precipitatie van geordende polymere structuren, bijvoorbeeld amyloïde fibrillen [90]. Dit kan leiden tot verschillende ziekten, zoals amyloïdose. In vitro-experimenten hebben aangetoond dat QD's gecoat met een hydrofiel polymeer de vorming van fibrillen van menselijke β2 versnellen microglobuline, die vervolgens worden gerangschikt in meerlagige structuren op het deeltjesoppervlak; dit resulteert in een lokale toename van de eiwitconcentratie op het NP-oppervlak, neerslag en vorming van oligomeren [91].
Xu et al. ontwikkelde een methode om de NP-lading van negatief naar positief te veranderen via verschillende modificaties van het oppervlak. Polymeer NP's werden bijvoorbeeld gemodificeerd met een pH-gevoelig polymeer zodat ze, negatief geladen in een neutraal medium, een positieve lading kregen in een zuur medium, bij pH 5-6 [92]. Deze techniek maakt het mogelijk om de snelheid van NP-opname door cellen aanzienlijk te verhogen, wat zou kunnen worden gebruikt voor medicijnafgifte aan tumorcellen. Schatting van de cytotoxiciteit van oppervlakte-gemodificeerde ceriumoxide-NP's voor H9C2-, HEK293-, A549- en MCF-7-cellen heeft aangetoond dat fundamenteel verschillende biologische en toxische effecten kunnen worden verkregen door verschillende polymeren te gebruiken om de NP's positief of negatief geladen of neutraal te maken. In het bijzonder worden positief geladen en neutrale NP's met dezelfde snelheid door alle celtypen geabsorbeerd, terwijl negatief geladen voornamelijk in tumorcellen accumuleren [93]. Door modificatie van de NP-lading kunnen hun lokalisatie en toxiciteit dus worden gecontroleerd, wat kan worden gebruikt voor het ontwikkelen van effectieve systemen voor het afleveren van chemotherapeutische geneesmiddelen aan tumoren.
Nanodeeltjesomhulsel en toxiciteit
Het aanbrengen van een schil op het oppervlak van NP's is nodig om hun optische, magnetische en elektrische eigenschappen te veranderen; het wordt gebruikt voor het verbeteren van de biocompatibiliteit en oplosbaarheid van NP in water en biologische vloeistoffen door hun aggregatiecapaciteit te verminderen, hun stabiliteit te vergroten, enz. De schaal vermindert dus de toxiciteit van NP's en biedt hen de capaciteit voor selectieve interactie met verschillende soorten cellen en biologische moleculen. Bovendien beïnvloedt de schaal de farmacokinetiek van NP aanzienlijk, waardoor de patronen van NP-distributie en accumulatie in het lichaam veranderen [94].
Zoals hierboven opgemerkt, is NP-toxiciteit grotendeels gerelateerd aan de vorming van vrije radicalen [40, 57, 95, 96]. De schaal kan dit negatieve effect echter aanzienlijk verminderen of elimineren, evenals NP's stabiliseren, hun weerstand tegen omgevingsfactoren vergroten, de afgifte van giftige stoffen daaruit verminderen of ze weefselspecifiek maken [97]. Cho et al. gemodificeerde polymere NP's door ze te coaten met lectines. De gemodificeerde NP's bonden selectief met tumorcellen die siaalzuurmoleculen op het oppervlak presenteren, waardoor de NP's geschikt waren voor het specifiek labelen van kankercellen [98].
Het NP-oppervlak kan worden gemodificeerd met zowel organische als anorganische verbindingen, bijvoorbeeld polyethyleenglycol, polyglycolzuur, polymelkzuur, lipiden, eiwitten, verbindingen met een laag molecuulgewicht en silicium. Deze verscheidenheid aan modificatoren maakt het mogelijk om complexe systemen op het NP-oppervlak te vormen voor het veranderen van de NP-eigenschappen en voor hun specifieke transport en accumulatie.
Nanodeeltjes bedekt met omhulsels van synthetische polymeren worden gebruikt voor de afgifte van antigenen, en dienen dus als adjuvantia om de immuunrespons te versterken. Dit maakt het mogelijk om vaccins te verkrijgen tegen de antigenen die het doelwit zijn van sterke natuurlijke niet-specifieke cellulaire immuniteit [99].
De schaal wordt vaak gebruikt voor het verbeteren van de solubilisatie en het verminderen van de toxiciteit van QD's, omdat hun metalen kernen hydrofoob zijn en voornamelijk bestaan uit giftige zware metalen, zoals cadmium, tellurium en kwik. De schaal verhoogt de stabiliteit van de QD-kern en voorkomt de ontzilting en oxidatieve of fotolytische degradatie. Dit vermindert op zijn beurt de lekkage van metaalionen buiten de QD-kern en daarmee de toxiciteit van QD's [100,101,102].
Onderzoek naar toxiciteit van nanodeeltjes
In de afgelopen twee decennia is het gebruik van NP's enorm uitgebreid en heeft geleid tot de oprichting van nanotoxicologie, een nieuwe wetenschap die de mogelijke toxische effecten van NP's op biologische en ecologische systemen bestudeert. Het algemene doel van nanotoxicologie is het ontwikkelen van de regels voor de synthese van veilige NP's [103]. Dit vraagt om een uitgebreide, systemische benadering van de analyse van de toxische eigenschappen van NP's en hun effecten op cellen, weefsels, organen en het lichaam als geheel.
Er zijn twee routinematige benaderingen voor de studie van de effecten van verschillende stoffen op levende systemen, die ook van toepassing zijn op NP-toxische effecten:in vitro experimenten op modelcellijnen en in vivo experimenten op laboratoriumdieren. We beschouwen hier niet de derde mogelijke benadering voor het schatten van NP-toxiciteit, computersimulatie, omdat de paden en mechanismen van de toxische effecten van NP's niet goed genoeg bekend zijn voor een computermodel om de gevolgen van interacties tussen NP's en levende materie voor een breed scala aan NP's met voldoende betrouwbaarheid.
Zowel celcultuur- als dierexperimentele modellen voor het bestuderen van NP-toxiciteit hebben hun specifieke voor- en nadelen. De eerste geven een dieper inzicht in de moleculaire mechanismen van toxiciteit en identificatie van de primaire doelen van NP's; er wordt echter geen rekening gehouden met de patronen van de verdeling van NP's in het lichaam en hun transport naar verschillende weefsels en cellen. De studie van NP-toxiciteit in dierproeven maakt het mogelijk om de vertraagde effecten van NP-actie in vivo in te schatten. However, the general pattern of toxicity manifestations becomes so complicated that it is impossible to determine which of them is the primary cause of the observed effect and which are its consequences.
Study of Toxicity in Cell Cultures
Many studies of NP toxicity are carried out in primary cell cultures serving as models of various types of human and animal tissues. In some cases, tumor cell lines are used, e.g., for estimating the toxic effects of NPs used in cancer chemotherapy. The type of cells is selected according to the potential route by which NPs enter the body. This may be oral uptake (mainly by ingestion), transdermal uptake (through the skin surface), inhalation uptake of NPs contained in the breathing air, or intentional NP injection in clinic. Intestinal epithelium cells (Caco-2, HT29, and SW480) are often used in experimental models for studying the toxicity of ingested NPs (Table 1). In these models, the kinetics of NP uptake by cells and the viability of cells upon the NP uptake are studied.
The NPs that serve as carriers of drugs or contrast agents, or those used for imaging, are administered by injection. The toxicity of these NPs is studied in primary blood cell cultures. Most commonly, hemolysis, platelet activation, and platelet aggregation are estimated. In addition to primary blood cell cultures, cultured HUVECs, mesenchymal stem cells, mononuclear blood cells, and various tumor cell lines (HeLa, MCF-7, PC3, C4-2, and SKBR-3) are used (Table 2).
The toxicity of inhaled NPs is studied using the cell lines modeling different tissues of the respiratory system, e.g., A549 and C10 cells of pulmonary origin, alveolar macrophages (RAW 264.7), various epithelial cells and fibroblasts (BEAS-2B, NHBE, 16-HBE, SAEC), as well as human monocytes (THP-1) (Table 3).
The toxicity of NPs that enter the body transdermally is usually studied in keratinocytes, fibroblasts, and, more rarely, sebocytes (cells of sebaceous glands) (Table 4).
Co-cultured Cell Lines and 3D Cell Cultures
Although the majority of in vitro nanotoxicity studies are carried out on cell monocultures, studies using two other approaches are increasingly often reported in the literature. One of them is co-culturing of several types of cells; the other is the use of 3D cultures. The rationale for these approaches is the need for more realistic models of mammalian tissues and organs. For example, co-cultured Caco-2 epithelial colorectal adenocarcinoma cells and Raji cells (a lymphoblast cell line) have served as a model of the human intestinal epithelium in experiments on the toxicity of silver NPs [104]. A co-culture of three cell lines derived from lung epithelial cells, human blood macrophages, and dendritic cells has been used as an experimental model in a study on the toxic effects of inhaled NPs [105]. A model of skin consisting of co-cultured fibroblasts and keratinocytes has been suggested [106].
It is known that the cell phenotype, as well as cell functions and metabolic processes, is largely determined by the complex system of cell interactions with other cells and the surrounding extracellular matrix [107]. Therefore, many important characteristics of cells with an adhesive type of growth in a monolayer culture substantially differ from those of the same cells in the living tissue; hence, conclusions from many experiments on the NP toxic effects on cells growing in a monolayer are somewhat incorrect [108]. Experimental 3D models of tissues and organs have been used for analysis of NP toxicity and penetration into cells in several published studies. For example, there are 3D models based on polymer hydrogels [109] and models constructed in special perfusion chambers containing a semipermeable membrane to which the cells are attached. Li et al. and Lee et al. [110, 111] used multicellular spheroids about 100 μm in size to obtain a 3D model of the liver and compare the toxicities of CdTe and Au NPs in experiments on this model and a monolayer culture of liver cells [111]. The results obtained using the 3D model were more closely correlated with the data obtained in experiments on animals, which indicates a considerable potential of this approach for adequate and informative testing of NP toxicity.
In vivo Study of Nanoparticle Toxicity
In addition to the study of multilayered and 3D cell cultures, the behavior of NPs in the living body is being extensively studied. Since these studies are focused on the biomedical applications of NPs, the NP toxicity for living organisms remains an important issue. Although NPs are highly promising for various clinical applications, they are potentially hazardous. This hazard cannot be estimated correctly in vitro, following from the comparison of the in vivo and in vitro effects of NPs.
Titaandioxide (TiO2 ) particles are among the most widely used NPs, in particular, in environment protection measures. Therefore, it was exceptionally important to estimate their toxicity in the case of a 100% bioavailability, namely, in experiments with their intravenous injection to experimental animals. This study has been performed by Fabian et al. [112]. Experimental animals (rats) were injected with a suspension of TiO2 NPs at a dose of 5 mg/kg, and their biodistribution, as well as the general condition of the animals, was monitored. The results have shown that the animals exhibit no signs of ailment or disorder, nor is inflammation or another manifestation of a toxic effect observed, within 28 days. This suggests that TiO2 NPs are relatively harmless.
Silver NPs are another example of NPs potentially useful in medicine, owing to their antimicrobial activity. Their toxicity and biodistribution were analyzed in an experiment where CD-1 mice were intravenously injected with 10 mg/kg of silver NPs of different sizes (10, 40, and 100 nm) coated with different shells. Although each type of NPs was found to cause toxic damage of tissues, larger particles were less toxic, probably, due to their lower penetration capacity [113]. Asare et al. [114] estimated the genotoxicity of silver and titanium NPs administered at a dose of 5 mg/kg. They have found that silver NPs cause DNA strand breaks and oxidation of purine bases in the tissues examined. Gold nanoparticles have a similar effect [115]. They have been shown to be toxic for mice, causing weight loss, decrease in the hematocrit, and reduction of the red blood cell count.
Targeted drug delivery is one of the most important applications of NPs. In this case, it is also paramount to know their toxic properties, because the positive effect of their use should prevail over the negative one. Kwon et al. [116] have developed antioxidant NPs from the polymeric prodrug of vanillin. Their study has shown that the NPs have no toxic effect on the body, specifically the liver, at doses lower than 2.5 mg/kg. Similar results have been obtained for gelatin NPs modified with polyethylene glycol, which are planned to be used for targeted delivery of ibuprofen sodium salt [117]. The NPs have proved to be nontoxic at the dose that is necessary for effective drug delivery (1 mg/kg), which has been confirmed by measuring the inflammatory cytokine levels in the animals studied, as well as histological analysis of their organs.
Quantum dots are among the NPs that are most promising for medical applications (Fig. 2). However, they are potentially hazardous for human health, because they exhibit various toxic effects in both in vitro and in vivo experiments [118,119,120,121,122].
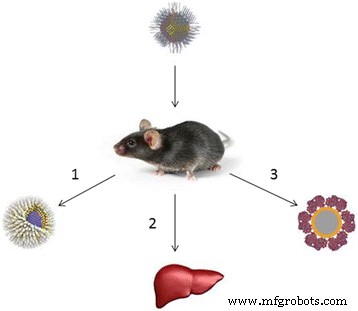
The possible reasons why quantum dots may be nontoxic in animal models. (1) The shell prevents the leakage of heavy metals into the body [129, 135]. (2) Quantum dots are localized in the liver and subsequently eliminated from the body [135, 173]. (3) The protein crown around quantum dots protects the body from heavy metals [132, 174]
Toxic effects of QDs in vivo are usually studied in experiments on mice and rats [123]. A study on the toxicity of cadmium-based QDs for mice showed that QDs were distributed throughout the body as soon as 15 min after injection to the caudal vein, after which they accumulated in the liver, kidneys, spleen, red bone marrow, and lymph nodes. Two years after the injection, fluorescence was mainly retained in lymph nodes; in other organs, no QDs were detected [124]. It should be also noted that the fluorescence spectrum was shifted to the blue spectral region because of the destruction of the QD shell and changes in the shape, size, and surface charge of the QDs. This, however, occurred rather slowly, because the QDs were found to be nontoxic after their injection at the doses at which pure cadmium ions would have had a lethal effect. Similar results were obtained by Yang et al. [125]. Zhang et al. [95] showed that CdTe QDs predominantly accumulated in the liver, decreasing the amount of antioxidants in it and inducing oxidative stress in liver cells.
Cadmium and tellurium ions tend to accumulate in various organs and tissues upon degradation and decay of the cores of CdTe/ZnS QDs. Experiments on mice have shown that cadmium predominantly accumulates in the liver, kidneys, and spleen, whereas tellurium accumulates almost exclusively in the kidneys [126]. Ballou et al. [127] found that cadmium-containing QDs coated with polymer shells of polyacrylic acid or different derivatives of polyethylene glycol had no lethal effect on experimental mice and remained fluorescent for 4 months. СdSe/ZnS NPs also had no detectable pathological effect on mice [128]; however, the absence of distinct signs of pathology still does not mean that the QDs are absolutely nontoxic.
Hu et al. [129] found that lead-containing QDs had no toxic effect on mice for 4 weeks; however, this was most probably because the QDs studied were coated with a polyethylene glycol shell.
Since heavy metals contained in QDs are a factor of their toxicity, several research groups suggested that heavy-metal-free NPs be synthesized. For example, Pons et al. [130] synthesized CuInS2/ZnS QDs fluorescing in the near-infrared spectral region (at a wavelength of about 800 nm) and supposed that this composition would make the QDs nontoxic for experimental animals. Comparison of the effects of CuInS2 /ZnS and CdTeSe/CdZnS QDs on regional lymph nodes in mice showed that the lymph nodes were only slightly, if at all, enlarged upon injection of the QDs not containing heavy metals, whereas injection of the CdTeSe/CdZnS QDs induced a distinct immune response in them [130]. QDs in which silicon was substituted for heavy metals also had no toxic effect on mice [131].
Even QDs containing heavy metals are often found to be nontoxic. One of the possible explanations is that QDs are coated with the protein crown upon entering the living body; this crown shields their surface and protects cells against damage [132]. Usually, the proteins that are included in the NP molecular corona are major serum proteins, such as albumin, immunoglobulin G (IgG), fibrinogen, and apolipoproteins [133]. Molecular corona also can influence on the interaction of NPs with cells. Zyuzin et al. have demonstrated that, in human endothelial cells, the NP protein corona decreases the NP nonspecific binding to the cell membrane, increases the residence time of NP in early endosomes, and reduces the amount of internalized NPs [134].
However, even in the absence of direct signs of intoxication in experimental animals, it remains unclear whether the use of QDs in medicine is safe for humans. In some cases, the QD toxicity was not detected in mice because the NPs were neutralized by the liver and accumulated in it [135]; in other cases, QDs coated with phospholipid micelles exhibited reduced toxicity owing to the shell [129]. Despite the extensive in vivo studies on QD toxicity, their use in biomedicine remains an open question. One of the main reasons is that all the delayed effects of QDs cannot be monitored in experimental animals, because their lifespan is as short as a few years, which is insufficient for complete elimination or degradation of NPs.
Conclusies
The potential toxicity of NPs is the main problem of their use in medicine. Therefore, not only positive results of the use of NPs, but also the possible unpredictable negative consequences of their action on the human body, should be scrutinized. The toxicity of NPs is related to their distribution in the bloodstream and lymph stream and their capacities for penetrating into almost all cells, tissues, and organs and interacting with various macromolecules and altering their structure, thereby interfering with intracellular processes and the functioning of whole organs. The NP toxicity strongly depends on their physical and chemical properties, such as the shape, size, electric charge, and chemical compositions of the core and shell. Many types of NPs are not recognized by the protective systems of cells and the body, which decreases the rate of their degradation and may lead to considerable accumulation of NPs in organs and tissues, even to highly toxic and lethal concentrations. However, a number of approaches to designing NPs with a decreased toxicity compared to the traditional NPs are already available. Advanced methods for studying the NP toxicity make it possible to analyze different pathways and mechanisms of toxicity at the molecular level, as well as reliably predict the possible negative effect at the body level.
Thus, it is obvious that designing NPs that have small or no negative effects is impossible unless all qualitative and quantitative physical and chemical properties of NPs are systematically taken into consideration and a relevant experimental model for estimating their influence on biological systems is available.
Afkortingen
- FDA:
-
Voedsel- en geneesmiddelenadministratie
- IL-1β:
-
Interleukin-1-beta
- MRT:
-
Magnetic resonance tomography
- NP:
-
Nanodeeltje
- QD:
-
Kwantumpunt
- ROS:
-
Reactive oxygen species
- SEM:
-
Scanning elektronenmicroscopie
- TEM:
-
Transmissie-elektronenmicroscopie
- TNFα:
-
Tumor necrosis factor alpha
Nanomaterialen
- Fysische en chemische eigenschappen van wolfraam
- Fysische eigenschappen van titanium
- Chemische eigenschappen van titanium
- Preparatie en magnetische eigenschappen van kobalt-gedoteerde FeMn2O4-spinel-nanodeeltjes
- Paramagnetische eigenschappen van van fullereen afgeleide nanomaterialen en hun polymeercomposieten:drastisch uitpompeffect
- Eigenschappen van longitudinale elektromagnetische oscillaties in metalen en hun excitatie op vlakke en sferische oppervlakken
- Synthese van in water oplosbare antimoonsulfide Quantum Dots en hun foto-elektrische eigenschappen
- Groene synthese van metaal- en metaaloxidenanodeeltjes en hun effect op de eencellige alg Chlamydomonas reinhardtii
- Eigenschappen van technische materialen:algemeen, fysiek en mechanisch
- 20 verschillende soorten metaal en hun eigenschappen
- Soorten metalen en hun eigenschappen



