Zeer gevoelige en selectieve detectie van H2S-gas met behulp van precipitatie en door impregnatie gemaakte CuO/SnO2 dikke films
Abstract
In dit werk, CuO-geladen tetragonale SnO2 nanodeeltjes (CuO/SnO2 NP's) werden gesynthetiseerd met behulp van precipitatie-/impregnatiemethoden met variërende Cu-gehalten van 0-25 gew.% en gekarakteriseerd voor H2 S-detectie. De materiaalfase, morfologie, chemische samenstelling en specifieke oppervlakte van NP's werden geëvalueerd met behulp van röntgendiffractie, transmissie-elektronenmicroscopie, scanning-elektronenmicroscopie, energiedispersieve röntgenspectroscopie, röntgenfoto-elektronspectroscopie en Brunauer-Emmett- Teller analyse. Uit gasdetectiegegevens blijkt de H2 S-reacties van SnO2 NP's werden sterk verbeterd door CuO-lading, vooral bij het optimale Cu-gehalte van 20 gew.%. De 20 gew.% CuO/SnO2 sensor vertoonde een uitstekende respons van 1,36 × 10 5 richting 10 ppm H2 S en hoge H2 S selectiviteit tegen H2 , SO2 , CH4 , en C2 H2 bij een lage optimale werktemperatuur van 200 °C. Bovendien zorgde de sensor voor een snelle respons en een lage detectielimiet van minder dan 0,15 ppm. De CuO–SnO2 sensor zou daarom een potentiële kandidaat kunnen zijn voor H2 S-detectie in omgevingstoepassingen.
Achtergrond
Waterstofsulfide (H2 S) is een zeer giftig gas dat op grote schaal wordt geproduceerd uit verschillende bronnen, zoals mestvergistingsinstallaties, afvalwaterbehandelingssystemen, aardolieraffinaderijen, stortplaatsen, textielfabrieken, stilstaande waterbronnen, geëxtrudeerde rubberindustrieën en andere soortgelijke industriële faciliteiten. H2 S kan worden geadsorbeerd door menselijke longen, gastro-intestinale gebieden en normale huid. De funky geur zal de reukzin bevriezen, wat leidt tot onmiddellijke verlamming en sterfte wanneer de concentratie de drempelwaarde (TLV) van 10 ppm [1] overschrijdt. Daarom is het dwingend een effectieve en goedkope gassensor te ontwikkelen die H2 . kan detecteren S bij sub-ppm concentraties met hoge respons, korte responstijd, hoge selectiviteit en goede stabiliteit.
Halfgeleidende metaaloxiden, zoals zinkoxide (ZnO), tindioxide (SnO2 ), titaandioxide (TiO2 ) en nikkeloxide (NiO), zijn uitgebreid bestudeerd voor verschillende gasdetectietoepassingen [2,3,4,5,6]. Onder hen tindioxide (SnO2 ) wordt beschouwd als het meest veelbelovende n-type metaaloxidegasdetectiemateriaal vanwege de lage kosten, diverse gasrespons, gemakkelijke doping, hoge chemische stabiliteit en brede werktemperatuur van 100 tot 600 °C [7, 8,9]. Het is met name gemeld als een van de meest aantrekkelijke kandidaten voor H2 S-detectie na de modificatie door doping met metallische doteermiddelen [10,11,12,13,14,15,16,17,18], belading met metaaloxide-nanodeeltjes [19,20,21,22,23,24,25, 26,27], en het vormen van nanocomposieten met verschillende metaaloxidehalfgeleiders [28, 29]. Echter, de H2 S-sensing-uitvoeringen van SnO2 nog verdere verbeteringen nodig.
Koperoxide (CuO) is een functionele p-type metaaloxidehalfgeleider met een matige energiekloof van 1,2–2,0 eV, opmerkelijke gevoeligheid en selectiviteit voor H2 S. CuO-geladen SnO2 gassensoren zijn uitgebreid gekarakteriseerd in de richting van H2 S zoals weergegeven in tabel 1. CuO-doteermiddelen bieden een relatief hoge versterking van H2 S respons en selectiviteit voor SnO2 sensoren [19,20,21,22,23,24,25,26,27]. De H2 S-waarnemingsprestaties hangen ook in grote mate af van de synthesemethode en de vorm van metaaloxidematerialen. Uit de tabel, recente rapporten CuO/SnO2 sensoren zijn meestal in dikke-film en dunne-film vormen, die vergelijkbare concurrerende H2 . bieden S-sensing-prestaties afhankelijk van de synthesemethode en voorbereidingsparameters. Tussen hen hebben dikke-filmsensoren meer de voorkeur in praktische toepassingen vanwege hun veel lagere productiekosten. Daarom is het dwingend om de H2 . te onderzoeken S-detectie-eigenschappen van dikke-film CuO/SnO2 materialen bereid door andere geavanceerde technieken.
Neerslag en impregnatie zijn aantrekkelijke methoden voor de productie van dikke-film nanocomposietmaterialen vanwege het vermogen om verschillende nanostructuren te vormen, lage verwerkingstemperatuur en lage kosten. Sommige CuO-geladen SnO2 nanomaterialen gesynthetiseerd door precipitatie met NH3 neerslagmiddel en impregnatie werden bestudeerd voor H2 S gasdetectie. De gerapporteerde resultaten boden echter nog steeds slechts een bescheiden respons bij hoge H2 S-concentraties mogelijk door grote deeltjesgroottes [28]. Hierin, neergeslagen SnO2 nanodeeltjes (NP's) werden bereid met NaOH als precipitatiemiddel en geïmpregneerd met CuO bij een breed scala aan Cu-gehalten om kleine nanodeeltjes en grote responsen te verkrijgen bij relatief lage H2 S-concentraties. Dikkefilmsensoren werden vervaardigd door spincoatingpoederpasta van gesynthetiseerd CuO/SnO2 nanodeeltjes en de effecten van CuO-ladingsniveau op H2 S-sensing-eigenschappen werden uitgelegd op basis van CuO/SnO2 heterojuncties.
Methoden
Synthese en karakterisering van nanodeeltjes
Alle chemicaliën met analytische kwaliteit werden direct gebruikt zonder extra zuivering. Tin (IV) chloride pentahydraat (SnCl4 ·5H2 O) als tinbron werd onder constant roeren opgelost in gedeïoniseerd (DI) water om de 0,1 M waterige oplossing te verkrijgen. Een geschikt volume 0,1 M natriumhydroxide (NaOH) waterige oplossing werd langzaam op de SnCl4 gedruppeld ·oplossing onder krachtig roeren totdat een witte slurry verscheen met een pH van 11. De slurry werd enkele malen grondig gewassen met DI-water onder centrifugeren om chlorideresten uit het neerslag te verwijderen. Het resulterende precipitaat werd vervolgens 10 uur bij 80°C in een oven gedroogd en de verkregen deeltjes werden 2 uur bij 600°C gecalcineerd met een verwarmingssnelheid van 10°C/min. Om CuO te impregneren op SnO2 nanodeeltjes, 0,872 g koper (II) acetaathydraat (98%; Aldrich) werd onder krachtig roeren opgelost in 30 ml ethanol. De oplossing werd vervolgens gedruppeld op 0,5 g SnO2 NP's met variërende Cu-concentraties van 5 tot 25 gew.%. Vervolgens werd de suspensie continu geroerd totdat deze in een homogene suspensie veranderde en gedurende 2 uur bij 60 ° C in een oven gebakken. De resulterende poeders werden 4 uur gegloeid bij 300 °C met een verwarmingssnelheid van 10 °C/min.
De structurele kenmerken van NP's werden geëvalueerd met behulp van röntgendiffractie (XRD) met een Cu Kα (λ = 1.54056 ) Röntgenbron. De oppervlaktemorfologie en elementaire distributies van NP's werden onderzocht met behulp van scanning transmissie-elektronenmicroscopen met hoge resolutie (HR-TEM). De oxidatietoestanden van materialen werden bestudeerd met behulp van röntgenfoto-elektronspectroscopie (XPS) met een Al-K α (1486,8 eV) röntgenbron. Het specifieke oppervlak van de NP's werd gemeten met behulp van een stikstofadsorptie-analysator met Brunauer-Emmett-Teller-analyse (SSABET ).
Vervaardiging en karakterisering van gassensor
SnO2 maken en 5-25 gew.% CuO/SnO2 sensoren werd 60 mg poeder grondig gemengd met een op α-terpineol (Aldrich, 90%) gebaseerd vehikel dat ethylcellulose (30-70 mPas, Fluka) bevatte om een homogene pasta te produceren. Vervolgens werd een sensorfilm afgezet op een aluminiumoxidesubstraat (0,40 × 0,55 × 0,04 cm 3 ) met voorgepatroneerde interdigitale gouden elektroden (0,24 cm × 0,5 cm) door spincoating van de pasta bij 700 tpm gedurende 10 s en bij 3000 tpm gedurende 30 s. De 200 nm dikke interdigitated Au-elektroden werden afgezet op aluminiumoxidesubstraten door een sputterproces met argongas bij een druk van 3 × 10 −3 mbar. De interdigit afstand, breedte en lengte waren respectievelijk 100 m, 100 m en 0,24 cm. De resulterende sensoren zoals geïllustreerd in Fig. 1 werden gedurende 2 uur bij 450 ° C gegloeid met een oplopende snelheid van 4 ° C / min om organische componenten uit de detectielagen te verwijderen. De microstructuren van detectiefilms werden gekarakteriseerd met behulp van veldemissie scanning-elektronenmicroscopie (FE-SEM) en energiedispersieve röntgenanalyse (EDS).
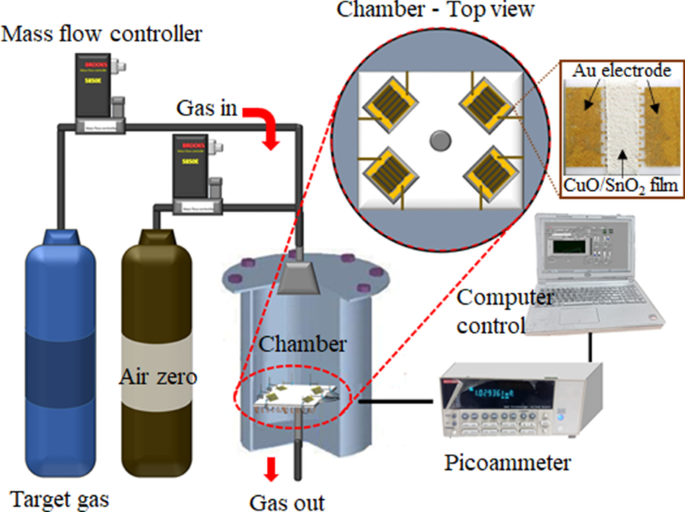
Gasgevoelig meetsysteem met de foto van een CuO/SnO2 sensor
Gasdetectiemeting
De sensorkarakteristieken in de richting van H2 S in het concentratiebereik van 0,15-10 ppm werd gemeten in een zelfgemaakte afgesloten roestvrijstalen testkamer met een actief volume van 0,5 L (Fig. 1). Een externe Ni/Cr-verwarmer die werkte met een computergestuurde voeding werd gebruikt om de werktemperatuur van 150 tot 350 ° C te regelen. De selectiviteitseigenschappen werden geëvalueerd tegen H2 , SO2 , CH4 en C2 H2 . Bij een bepaalde werktemperatuur werden de sensoren aanvankelijk gedurende 10 minuten in synthetische droge lucht bezonken om een constante luchtweerstand te verkrijgen. Vervolgens werd de droge lucht gemengd met een doelgasmonster tot een gewenste gasconcentratie bij een vaste totale stroomsnelheid (2 l/min) met behulp van gecomputeriseerde meerkanaals massastroomregelaars (Brook Instruments model 5850E). Elk gasmonster werd gedurende 25 minuten op de sensoren aangebracht en de droge lucht werd gedurende 45 minuten hervat. De sensorweerstand werd gemeten met de amperometrische methode bij een voorspanning van 10 V DC met behulp van een picoampèremeter (Kiethley-model 6487). De prestaties van sensoren met verschillende Cu-concentraties werden gekarakteriseerd in termen van gasrespons, responstijd, selectiviteit en stabiliteit. De gasrespons (S ) werd uitgedrukt als S = R een /R g voor een reducerend gas (H2 S, H2 , CH4 , SO2 en C2 H2 ), waarbij R een en R g waren respectievelijk de sensorweerstand in lucht voor en na blootstelling aan een doelgas. De reactietijd (t res ) was de tijd die nodig was om 90% van een steady-state responssignaal te bereiken bij blootstelling aan een doelgas.
Resultaten en discussie
Structurele kenmerken van deeltjes en waarnemingsfilm
XRD-patronen van CuO, SnO2 , en 5-25 gew.% CuO/SnO2 NP's worden weergegeven in Fig. 2. De scherpe diffractiepieken geven de kristallijne karakteristiek van alle NP's aan. De diffractiepatronen van SnO2 en CuO komen overeen met tetragonale en monokliene structuren volgens respectievelijk JCPDS-bestanden nr. 41-1445 en 45-0937. De SnO2 poeder vertoont drie hoofdpieken, terwijl het CuO-poeder twee verschillende hoofdpieken vertoont. De spectra voor de 5-25 gew.% CuO/SnO2 NP's tonen de secundaire CuO-pieken van (002) en (111) vlakken samen met de belangrijkste SnO2 pieken van (111), (101) en (211) vlakken, die het naast elkaar bestaan van CuO en SnO2 aantonen fasen. De gemiddelde kristallietgroottes (d ) van CuO/SnO2 NP's werden bepaald met behulp van de vergelijking van Scherrer (d = Kλ /(β cosθ ) waar K is de geometrische factor van 0,89 voor bolvormige deeltjes, λ is de röntgengolflengte en β is de volledige breedte op het halve maximum van een XRD-piek onder de hoek, θ . De gemiddelde kristallietdiameter van onbeladen SnO2 wordt geschat op 10 nm, terwijl dat van 20 gew.% CuO/SnO2 NP's zijn relatief klein bij 7 nm. Het resultaat geeft de remming van de korrelgroei aan als gevolg van CuO-lading op SnO2 NP's. De chemische samenstelling en oxidatietoestanden van CuO- en SnO-nanodeeltjes zullen verder worden geëvalueerd door EDX- en XPS-analyses.
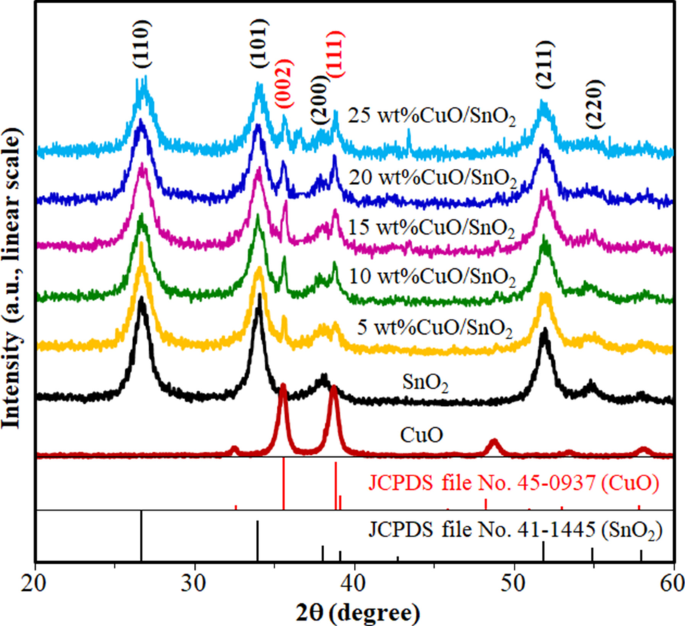
XRD-patroon van CuO, SnO2 en 5-25 gew.% CuO/SnO2 NP's
INZET-specifieke oppervlakten (SSABET ) en deeltjesdiameters (d BET ) van SnO2 en 5-25 gew.% CuO/SnO2 NP's worden getoond in Fig. 3. SSABET van CuO/SnO2 NP's nemen aanzienlijk toe van 39,9 naar 44,21 m 2 /g, terwijl de d BET vermindert dienovereenkomstig van 22,04 tot 19,53 nm naarmate het CuO-gehalte stijgt van 0 tot 20 gew.%. Naarmate het Cu-gehalte verder toeneemt tot 25 gew.%, wordt SSABET neemt licht af tot 44,01 m 2 /g en d BET neemt toe tot 19,62 nm. De resultaten komen overeen met de XRD-analyse van de kristallietgrootte. De invloed van CuO-laadniveau op SSABET kan worden toegeschreven aan de opname van kleinere CuO NP's geproduceerd door impregnatie. De CuO NP's kunnen fungeren als afscheiders om zelfcoagulatie tussen SnO2 te remmen NP's, wat resulteert in een aanzienlijke toename van het effectieve oppervlak.
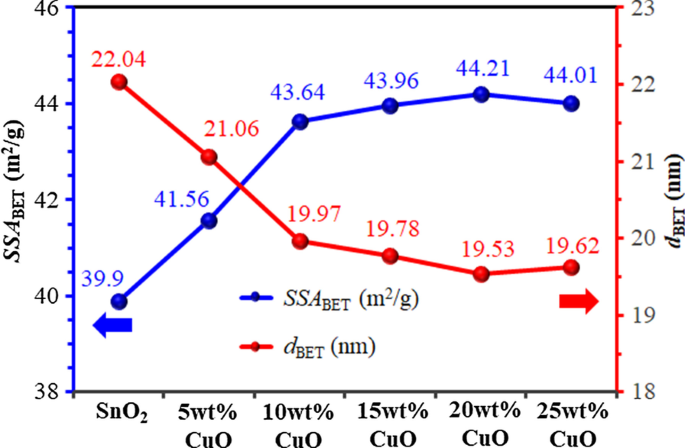
INZET-specifieke oppervlakte (SSABET ) en deeltjesdiameter (d BET ) van SnO2 en 5-25 gew.% CuO/SnO2 NP's
Figuur 4 toont typische oppervlaktemorfologieën van coprecipitatie/impregnatie gesynthetiseerd SnO2 en 20 gew.% CuO/SnO2 NP's. De BF-TEM-beelden laten zien dat de meeste SnO2 deeltjes vertonen bolvormige vormen met verschillende diameters variërend van 5 tot 20 nm. Na CuO-lading, de diameters van SnO2 NP's zijn meestal kleiner, maar de secundaire fase van CuO kan niet duidelijk worden geïdentificeerd (Fig. 4d-f). De gerelateerde SAED-patronen vertonen gestippelde ringkenmerken van polykristallijn tetragonaal SnO2 structuren met hoofddiffractieringen die overeenkomen met (110), (101), (200), (211) en (112) vlakken van SnO2 evenals (002) vlak van CuO in overeenstemming met de XRD-analyse. De ringen die verband houden met CuO waren vrij obscuur vanwege waarschijnlijk een zwak diffractiesignaal van de zeer kleine CuO secundaire fase. Dienovereenkomstig tonen de HR-TEM-afbeeldingen roosterranden op nanodeeltjes die voornamelijk worden geassocieerd met de vlakken van SnO2 Kristallen. De secundaire CuO-fasestructuren kunnen niet worden waargenomen in het HR-TEM-beeld vanwege hun zeer kleine afmetingen buiten de resolutie van het TEM-instrument.

BF-TEM- en HR-TEM-beelden met bijbehorende SAED-patronen van a –c SnO2 NP's en d –f 20 gew.% CuO/SnO2 NP's
Scanning-transmissie-elektronenmicroscopie (STEM) en EDS-mapping-analyse met hoge resolutie werden gebruikt om de distributies van CuO in 20 gew.% CuO/SnO2 te onderzoeken NP's zoals weergegeven in Fig. 5. Het STEM-beeld illustreert een cluster van ruwweg ronde nanodeeltjes met diameters in het bereik van 5-15 nm in overeenstemming met de TEM-afbeeldingen, maar met een relatief lage beeldresolutie als gevolg van scanafwijking. De overeenkomstige EDS-kaarten van Sn-, O- en Cu-elementen tonen de gedetailleerde verspreiding van deze soorten op verschillende SnO2 nanodeeltjes in het geselecteerde gebied. Blijkbaar zijn Cu-soorten wijd verspreid op deeltjes met een vergelijkbare dichtheid als Sn- en O-soorten. De resultaten suggereren dat de CuO secundaire nanodeeltjes aanwezig zijn en nauw verdeeld zijn op SnO2 oppervlakken die verdeeld CuO–SnO2 . vormen kruispunten binnen de CuO/SnO2 composiet. De deeltjes en gerelateerde knooppunten zijn echter erg klein op moleculaire schaal, zodat ze niet precies kunnen worden onderscheiden door de TEM/STEM-karakteriseringen.

Scanning-TEM (STEM)-afbeelding en bijbehorende elementaire EDS-kaarten van 20 gew.% CuO/SnO2 NP's
Afbeelding 6 illustreert de transversale morfologieën en chemische samenstellingen van SnO2 en 20 gew.% CuO/SnO2 films. Beide lagen zijn ongeveer 20 m dik en omvatten op dezelfde manier geagglomereerde deeltjes op vaste gestructureerde substraten. De elementaire composities van SnO2, en 20 gew.% CuO/SnO2 staan vermeld in de inzettabellen van Fig. 5b, d. Het onthult dat de atomaire inhoud van Sn en O van SnO2 NP's zijn lager dan de verwachte waarden (33:67) van stoichiometrische SnO2 . Bij 20 gew.% CuO-lading verschijnt een Cu-piek met een hoog Cu-gehalte van ~-15,6 gew.% of 7,04 at%, wat nog steeds kleiner is dan dat van Sn. Bovendien blijkt het Cu-gehalte van vijf verschillende gebieden te variëren van 14 tot 18 gew.%, wat wijst op enige variatie in chemische samenstelling binnen de film. Daarom heeft CuO-belading door impregnatie geen duidelijke invloed op de deeltjesmorfologieën, maar verandert de elementaire samenstelling aanzienlijk.
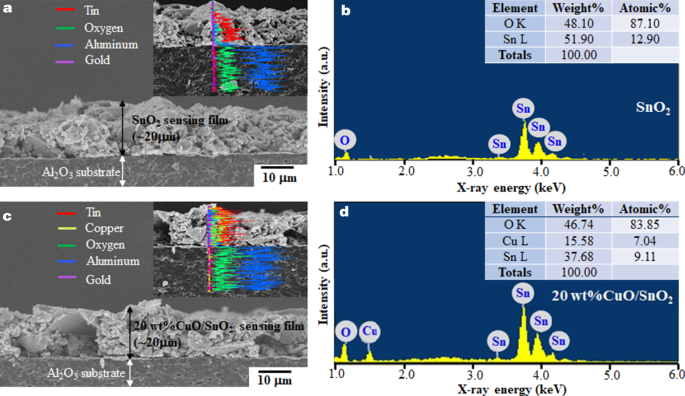
Transversale FE-SEM-beelden met EDS-lijnscanprofielen (inzet) en bijbehorende EDS-spectra met elementaire compositietabellen (inzet) van de a , b SnO2, en c , d 20 gew% CuO/SnO2 NP's die films waarnemen
Afbeelding 7 toont de oxidatietoestanden van elementen in SnO2 en 20 gew.% CuO/SnO2 NP's. Het XPS-onderzoeksspectrum van SnO2 onthult de aanwezigheid van C, O en Sn, terwijl die van 20 gew.% CuO/SnO2 toont het bestaan van C, O, Sn en Cu aan. De resultaten bevestigen de vorming van CuO/SnO2 composieten met typische organische/koolstofverontreinigingen op oppervlakken. Voor het Sn-element is de Sn3d5/2 en Sn3d3/2 doubletpieken van SnO2 en 20 gew.% CuO/SnO2 NP's worden op dezelfde manier waargenomen bij de bindingsenergieën van respectievelijk 486,8-487,1 eV en 495,2-495,5 eV. De pieklocaties kunnen worden toegewezen aan de Sn 4+ oxidatietoestand van SnO2 [29]. In het geval van 20 gew.% CuO/SnO2 NP's, de Cu2p-kernniveaus omvatten Cu2p 3/2 en Cu2p 1/2 pieken gecentreerd op 933,5 eV en 953,4 eV samen met de satellietpieken op ~ 942.9 en ~ 964.2 eV, overeenkomend met de Cu 2+ oxidatietoestand van CuO [30]. De waargenomen oxidatietoestanden bevestigen het naast elkaar bestaan van CuO en SnO2 structuren.
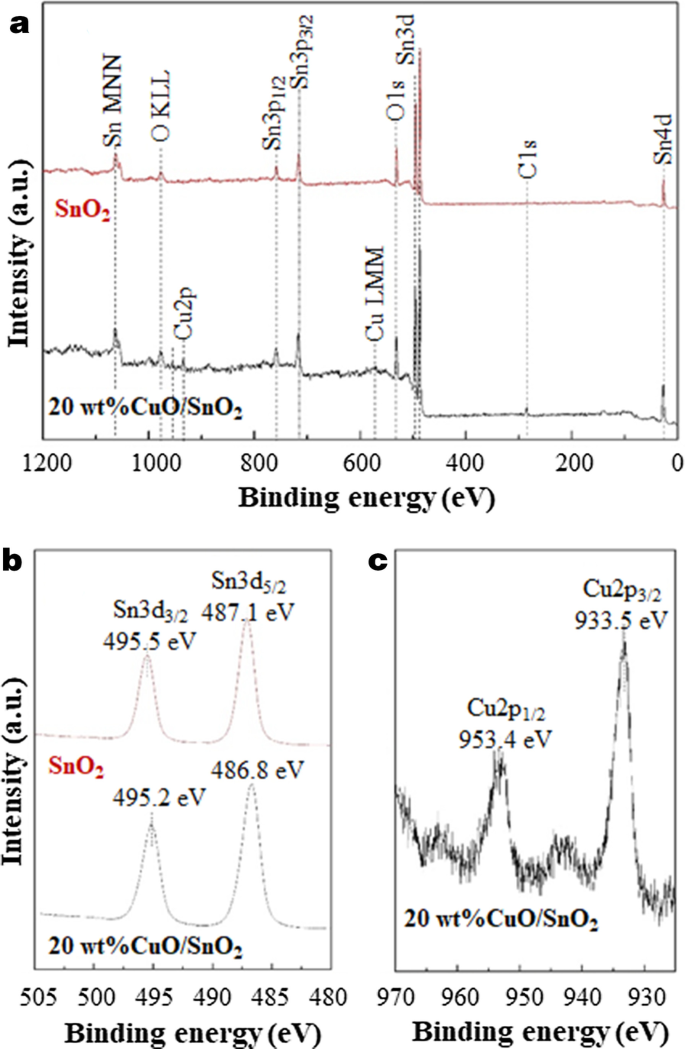
een Onderzoek en hoge resolutie XPS-spectra van de b Sn3d en c Cu 2p kernniveaus van SnO2 en 20 gew.% CuO/SnO2 NP's
Gasdetectiekenmerken
Afbeelding 8a toont de veranderingen in weerstand van CuO, SnO2 en 5-25 gew.% CuO/SnO2 films onderworpen aan H2 S pulseert met variërende concentraties van 0,15 tot 10 ppm bij een werktemperatuur van 200 °C. De weerstand in lucht van SnO2 film neemt toe met meer dan twee ordes van grootte na het laden van CuO met 5-25 gew.% inhoud. Bovendien wordt waargenomen dat de basislijnweerstanden van verschillende CuO/SnO2 sensoren zijn niet erg verschillend en nemen slechts licht toe met toenemende CuO-belasting. Om te bepalen of de weerstand is veranderd vanwege de filmgeometrie of materiaalgerelateerde eigenschappen, werd de filmweerstand bovendien gemeten met de bekende vier-sondemethode met behulp van 4-stripe Au/Cr-elektroden met een interelektrode-afstand van 100 m en een bias stroom van 0,1 A. De gemeten gemiddelde weerstandswaarden van CuO, SnO2 , en 5-25 gew.% CuO/SnO2 films in lucht bij 350 °C zijn ~ 8.1 × 10 3 , 2.1 × 10 4 en 7,4 × 10 7 − 1.8 × 10 8 Ω cm, respectievelijk. De resultaten bevestigen significante verschillen in soortelijke weerstand tussen de drie sets materialen en de overeenkomsten in soortelijke weerstand tussen 5-25 gew.% CuO/SnO2 films. Dit gedrag kan worden verklaard op basis van twee effecten, waaronder het breken van de percolatie van geaggregeerd SnO2 nanodeeltjes door CuO secundaire nanodeeltjes en de vorming van CuO/SnO2 (p-n) heterojuncties. De TEM/HR-TEM/STEM-gegevens suggereren dat secundaire CuO-nanodeeltjes kunnen worden gevormd rond de SnO2 nanodeeltjes, waardoor de percolatie van geagglomereerd SnO2 . wordt verbroken deeltjes en dwingt de meeste geleidingspaden over de CuO-nanodeeltjes te lopen. Bovendien is de vorming van CuO/SnO2 heterojuncties kunnen dragerdepletiegebieden induceren in secundaire CuO-nanodeeltjes vanwege het verschil in werkfunctie, waardoor geleidingspaden met hoge weerstand ontstaan. Dus een toevoeging van CuO aan SnO2 deeltjes op het niveau boven de minimumwaarde die nodig is om de percolatie van SnO2 . te breken deeltjes zullen een grote toename van de weerstand veroorzaken, aangezien volledig uitgeputte CuO-deeltjes de elektrische geleiding blokkeren. Het laagste Cu-gehalte in deze studie van 5% is behoorlijk substantieel en zal dus waarschijnlijk de percolatiebrekende drempel overschrijden. Verdere toevoeging van CuO zal de weerstand slechts licht verhogen, aangezien de elektrische geleiding via volledig verarmd CuO al bijna minimaal is. Andere effecten, waaronder deeltjes-/korrelgroottes, filmdikte, elektrodescheiding en elektrodecontact, kunnen worden verwaarloosd omdat ze niet sterk veranderen volgens de structurele karakteriseringsresultaten. Bij blootstelling aan H2 S, de sensorweerstanden nemen snel af voordat ze terugkeren naar de basisniveaus na de hervatting van droge lucht, wat een typische n-type detectiekarakteristiek bevestigt. Interessant is dat de basislijnweerstand van de CuO-sensor aanzienlijk naar beneden drijft na verschillende H2 S pulsen in tegenstelling tot de SnO2 sensor die een onbeduidende basislijnafwijking vertoont. In het geval van CuO/SnO2 sensoren, heeft de basislijndrift de neiging toe te nemen met toenemend Cu-gehalte. Dit gedrag kan verband houden met de langzame en onvolledige CuO-CuS-transformatieve reacties die verder worden besproken in Sect. 3.3.
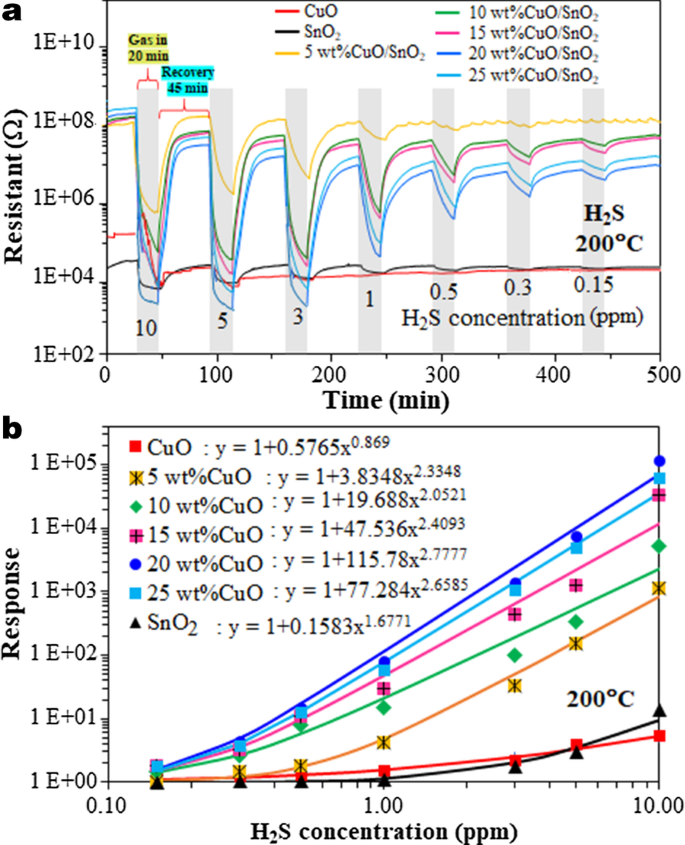
een Dynamische respons van CuO, SnO2 en 5-25 gew.% CuO/SnO2 gassensoren onderworpen aan 0,15 tot 10 ppm H2 S pulseert bij 200 °C en b corresponderende sensorrespons vs. H2 S-concentratie
De corresponderende sensorrespons uitgezet tegen H2 S-concentratie bij 200 ° C wordt getoond in Fig. 8b. Alle sensorreacties nemen monotoon toe met toenemende H2 S-concentratie. De responskarakteristieken van alle sensoren voldoen goed aan de machtswet volgens de vergelijkingen zoals weergegeven samen met de inzetlabels in Fig. 8b. De machtswet-exponent van CuO ligt dicht bij 1, terwijl die van SnO2 sensoren is ongeveer 1,5 en die van CuO-geladen SnO2 sensoren zijn groter dan 2, wat duidt op verschillen in H2 S reactiemechanismen op de oppervlakken van deze materialen [31]. Bovendien neemt de sensorrespons sterk toe naarmate het CuO-gehalte toeneemt van 0 tot 20 gew.% voordat het licht afneemt bij een hoger CuO-gehalte van 25 gew.% en het 20 gew.% CuO/SnO2 sensor biedt de hoogste respons van 1,36 × 10 5 tot 10 ppm H2 S bij 200 °C. Bovendien vertoont het fatsoenlijke reacties van ~ 2, 5, 20 en 230 bij de lagere H2 S-concentraties van respectievelijk 0,15, 0,3, 0,5 en 1 ppm. De uitstekende prestaties van 20 gew.% CuO/SnO2 sensor kan worden toegeschreven aan de toename van het specifieke oppervlak als gevolg van CuO-belasting en de vorming van CuO/SnO2 heterojuncties worden in de volgende sectie verder besproken.
Afbeelding 9 geeft de grafiek weer van de respons versus de werktemperatuur van onbelaste en CuO-geladen SnO2 sensoren op een H2 S-concentratie van 10 ppm. De H2 S-reacties van CuO/SnO2 NPs-sensoren nemen aanzienlijk toe bij toenemende temperatuur van 150 tot 200 °C en nemen vervolgens snel af wanneer de temperatuur verder stijgt. Daarom is 200 °C de optimale werktemperatuur van de met CuO geladen SnO2 sensoren. Met name de optimale 20 gew.% CuO/SnO2 sensor geeft de hoogste respons van 1,36 × 10 5 , wat veel hoger is dan die van andere sensoren bij 200 °C. De optimale werktemperatuur van 200 °C komt overeen met de temperatuur die de H2 . maximaliseert S-adsorptiesnelheid ten opzichte van de desorptiesnelheid van CuO/SnO2 oppervlakken. Verder 5-25 gew.% CuO/SnO2 sensoren geven een lagere optimale werktemperatuur weer dan die van SnO2 sensor (250 °C). De relatief lage optimale werktemperatuur zal vervolgens worden verklaard door CuO-belastingseffecten.
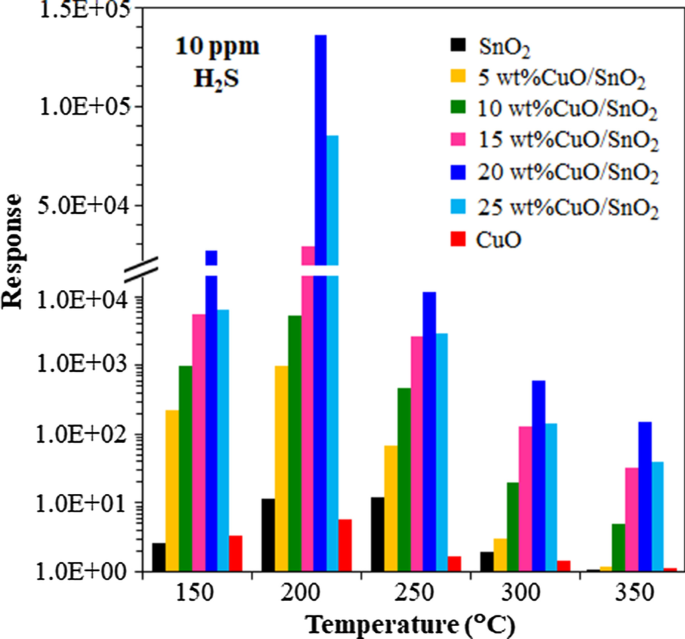
Effect van werktemperatuur op reactie op 10 ppm H2 S van CuO, SnO2 en 5-25 gew.% CuO/SnO2 sensoren
Afbeelding 10 geeft een samenvatting van de H2 S-selectiviteit van 0-25 gew.% CuO/SnO2 sensoren tegen SO2 , H2 , CH4 en C2 H2 . Dit type sensor vertoont de hoogste H2 S selectiviteit, d.w.z. meer dan drie ordes van grootte hoger H2 S-respons dan die van andere gassen. De gegevens bewijzen dat CuO de katalysator is die selectief de reactie met H2 . versnelt S. Het selectiviteitsgedrag kan ook worden toegeschreven aan de toename van actieve sites voor H2 S-adsorptie door het hoogste specifieke oppervlak van 20 gew.% CuO/SnO2 NP's. De verbeteringen voor andere geteste gassen zijn niet significant, waarschijnlijk vanwege de relatief zwakke interacties tussen gasmoleculen en 20 gew.% CuO/SnO2 NP's. De behaalde H2 S-reacties van 20 gew.% CuO/SnO2 sensoren zijn aanzienlijk beter dan die van veel andere met metaal beladen SnO2 en CuO-geladen SnO2 sensoren gemaakt met verschillende technieken zoals vermeld in tabel 1. De bereikte optimale werktemperatuur van 200 °C is echter hoger dan de waarden van sommige rapporten bij 100-150 °C. De lagere werktemperatuur heeft in het algemeen de voorkeur in praktische toepassingen. Niettemin is de 20 gew.% CuO/SnO2 sensor kan werken bij een lagere werktemperatuur van 150 °C, waarbij de sensor nog steeds een hoge respons vertoont van 3,1 × 10 4 tot 10 ppm H2 S (Fig. 9), die ook hoger is dan de responswaarden van andere sensoren die worden vermeld in Tabel 1. Daarom is de met CuO geladen SnO2 sensor is een veelbelovende kandidaat voor H2 Sensing vanwege de hoge H2 S-reactie, hoge H2 S selectiviteit en lage werktemperatuur.
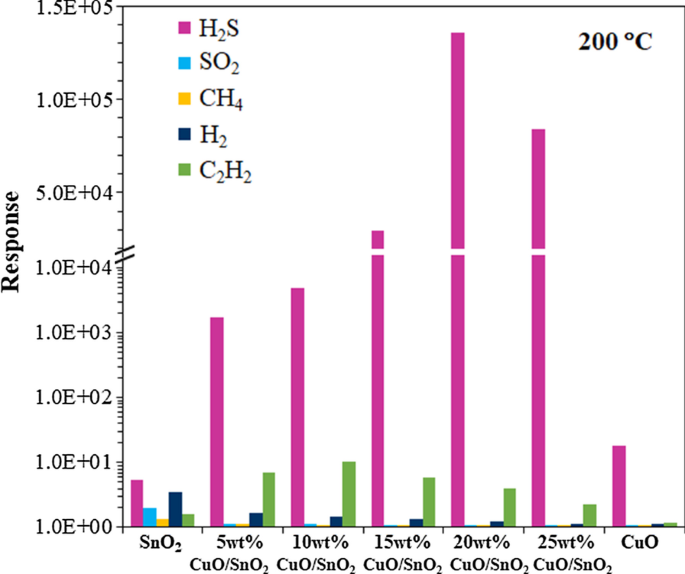
Reacties van CuO, SnO2 en 5-25 gew.% CuO/SnO2 sensoren richting H2 S (10 ppm), SO2 (200 ppm), CH4 (1000 ppm), H2 (1000 ppm) en C2 H2 (1000 ppm) bij 200 °C
Ten slotte de stabiliteit, herhaalbaarheid en reproduceerbaarheid van CuO/SnO2 sensoren werden geëvalueerd van vier monsters die in dezelfde batch waren geproduceerd. Alle sensoren vertoonden een goede stabiliteit met minder dan 15% drift in sensorrespons gedurende 1 maand onder dezelfde bedrijfsomstandigheden. Bovendien vertoonde elke sensor een goede herhaalbaarheid met minder dan 12% responsvariatie van 8 herhaalde metingen. Bovendien bleken vier sensoren uit dezelfde batch een redelijke responsvariatie van minder dan 26% te hebben, geëvalueerd onder dezelfde testomstandigheden.
Gasdetectiemechanismen
De karakteriseringsresultaten suggereren de vorming van CuO/SnO2 composiet bestaande uit zeer kleine CuO-soorten op SnO2 nanodeeltjes. Dus de mechanismen voor elektrische respons van CuO/SnO2 films voelen richting H2 S kan worden beschreven op basis van de samengestelde junctietheorie van pn-overgangen bij de contacten tussen p-type CuO en n-type SnO2 zoals weergegeven in Afb. 11. Voor ongedoteerde SnO2 , chemisch geabsorbeerde zuurstofsoorten (O − ) worden gevormd, wat resulteert in de vorming van uitputtingsgebieden op het oppervlak bij een matige temperatuur. Bij blootstelling aan H2 S, H2 S-moleculen interageren met geadsorbeerde zuurstofspecies op SnO2 oppervlak (H2 S + 3O − → H2 O + SO2 + e − ), elektronen vrijgeven aan SnO2 geleidingsband en het verminderen van de sensorweerstand. Bij een lage werktemperatuur van 200 °C is de concentratie van zuurstofspecies erg laag, wat leidt tot een lage reactiesnelheid en een lage H2 S-reactie. Met CuO-lading zullen extra uitputtingsgebieden worden gevormd op verschillende pn-overgangen rond het oppervlak van SnO2 nanodeeltjes. Bovendien, dragers in secundaire CuO-nanodeeltjes, die de percolatie van geaggregeerd SnO2 kunnen breken nanodeeltjes, kunnen volledig worden uitgeput, wat resulteert in een hoge elektrische weerstand in de lucht. In ambient met H2 S kunnen de gasmoleculen bovendien reageren met de katalytische CuO NP's, wat leidt tot de vorming van kopersulfide (CuS) via de reactie (Vgl. 1) [26]:
$${\text{CuO}} + {\text{H}}_{2} {\text{S}} \to {\text{CuS}} + {\text{H}}_{2} { \text{O}}$$ (1)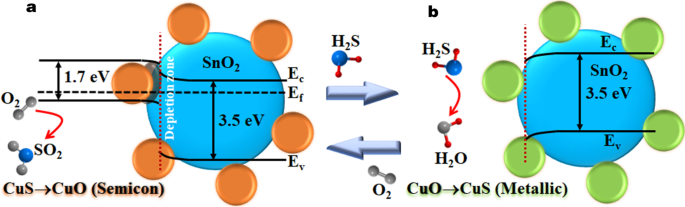
Energiebanddiagrammen van CuO/SnO2 heterojuncties a voor en b na blootstelling aan H2 S (E f = Fermi-energieniveau, E C = geleidingsband en E V = valentieband)
CuS is more conductive than CuO, leading to lower potential barriers at depletion regions around the interfaces. The induction of metallic CuS is equivalent to the injection of free electrons into the p-type material (CuO), making it less p-type. This encourages the electron transfer from CuS to SnO2 , resulting in additional decrease of depletion width and increase of the electrical conductance of SnO2 . The decrease of resistance due to the formation of CuS is much larger than the reduction due to the reducing reaction with oxygen species due to transfer of more electrons from CuS. At low CuO contents, there are relatively few and small CuO nanoparticles that are fully transformed into CuS surrounding SnO2 deeltjes. It will provide a limited amount of electrons to SnO2 due to relatively few heterojunctions, resulting in small reduction of depletion region widths in SnO2 and small resistance drop upon H2 S exposure. As the CuO content increases, the numbers of transformed CuS nanoparticles and heterojunctions increase, leading to an increased number of conduction paths through CuS as well as much reduced SnO2 depletion region widths and thus a higher resistance drop that can be achieved after H2 S exposure. However, CuO particles may coalesce into large ones and the number of CuO/SnO2 heterojunctions becomes lower at very high CuO content (> 20 wt%). The large CuO particles will not be fully transformed to CuS due to limited reaction depth with H2 S and the depletion regions in CuO cores remain, limiting the conduction through CuO and reducing attainable resistance drop. In the case of CuO, the response is low despite the formation of CuS because the resistance of CuO is already low and is not much higher than that of CuS [20]. After H2 S in atmosphere extinguishes, the electrical resistance returns to its original values as CuS can be reoxidized to CuO in air at an elevated temperature according to the reaction (Eq. 2) [26]:
$${\text{CuS}} + {\text{O}}_{2} \to {\text{CuO}} + {\text{SO}}_{2}$$ (2)The oxidation of CuS is slow at a low working temperature. As the increase of working temperature, the oxidation rate increases and lead to the increase of recovery rate. Since the CuS–CuO transformative reaction (Eq. (2)) is slower than the CuO–CuS one (Eq. (1)) at this working temperature, residual CuS materials can remain after subjecting CuO to several H2 S pulses. This results in a substantial downward baseline drift of CuO sensor and the increase of baseline drift with increasing Cu content of CuO/SnO2 sensors as previously observed in Fig. 8a. However, there is an exception in the case of 5 wt% CuO/SnO2 sensor, which exhibits a small upward drift of baseline resistance after the first pulse. It may occur because the sensor did not fully reach the steady state before applying the first pulse leading to some upward recovery owing to oxidation in air while the drift due to CuS–CuO transformation at this low Cu content is relatively small due to a low residual CuS content. At higher Cu contents, the downward drifts due to residual CuS are large and overwhelm the small upward recovery. The baseline drift considerably reduces the validity, repeatability and stability of sensor response of CuO/SnO2 as the response to a subsequent H2 S pulse is affected by the residual CuS concentration after the previous H2 S exposure leading to negative deviations from the ideal response behavior. Thus, the calculated responses of the CuO/SnO2 sensors especially with high Cu contents in Fig. 8b are lower the theoretical values under no residual CuS condition. The problems can be reduced by increasing the working temperature. Thus, the sensors may operate above the optimal working temperature at 250 °C when the drift is low, and response is still high. CuS structure can be formed at 103 °C and will be transformed into Cu2 S, a less conductive ionic conductor, at the temperature above 220 °C [26]. Consequently, the sensor response of CuO/SnO2 NPs decreases when the temperature rises above 200 °C. The observed high H2 S selectivity against SO2 , H2 , CH4 en C2 H2 can also be explained in relation to the working temperature. At the optimal working temperature of 200 °C, the rate of CuO–CuS transformation is high, while the reducing reaction rates of SO2 , H2 , CH4 en C2 H2 are very low because these reactions require the chemisorbed oxygen species whose density is still very low at this working temperature.
Conclusies
0–25 wt% CuO/SnO2 NPs were fabricated using the precipitation and impregnation method. XRD, BET, TEM, SEM, EDS and XPS data suggested the loading of very small CuO nanoparticles on larger SnO2 NP's. The gas-sensing results demonstrated that CuO loading greatly enhanced the H2 S response of SnO2 NPs with an optimal Cu content of 20 wt%. The 20 wt%CuO/SnO2 sensor can perceive low-ppm H2 S concentrations with ultra-high responses (1.4 × 10 5 at 10 ppm), short response times (35 s), fair recovery times (a few minutes), very high H2 S selectivity against SO2 , CH4 , H2 en C2 H2 and good stability. They could also offer a wide detection range (0.15–10 ppm) when compared with the unloaded one (3–10 ppm). Therefore, the CuO/SnO2 sensors synthesized by precipitation and impregnation could be a promising candidate for H2 S detection in environmental applications.
Beschikbaarheid van gegevens en materialen
The datasets supporting the conclusions of this article are included in the article.
Afkortingen
- NP's:
-
Nanodeeltjes
- XRD:
-
Röntgendiffractie
- HR-TEM:
-
Transmissie-elektronenmicroscopie met hoge resolutie
- FE-SEM:
-
Veldemissie scanning elektronenmicroscopie
- EDX:
-
Energie-dispersieve röntgenspectroscopie
- AFM:
-
Atoomkrachtmicroscopie
- BET:
-
Brunauer–Emmett–Teller
- SSABET :
-
Specific surface area
- XPS:
-
Röntgenfoto-elektronenspectroscopie
Nanomaterialen
- Een CMMS gebruiken om de productiviteit van technici in de olie- en gasindustrie te verbeteren
- Promotie op Aceton Sensing van Single SnO2 Nanobelt door Eu Doping
- Verbetering van de amperometrische transducerselectiviteit met behulp van fenyleendiaminefilms van nanoformaat
- Groot-gebied, zeer gevoelige SERS-substraten met zilveren nanodraad dunne films gecoat door microliter-schaal oplossingsproces
- Vervaardiging van SrGe2 dunne films op Ge (100), (110) en (111) substraten
- Voorbereiding en optische eigenschappen van GeBi-films met behulp van de moleculaire straal-epitaxiemethode
- Zeer gevoelige chemische ethanolsensor op basis van nieuwe, met Ag-gedoteerde mesoporeuze α–Fe2O3, bereid met gemodificeerd sol-gel-proces
- Gecontroleerde synthese en selectieve adsorptie-eigenschappen van Pr2CuO4-nanobladen:een discussie over het mechanisme
- Voordelen van het gebruik van Smart Gas Monitoring Solutions in de olie- en gasindustrie
- Toepassingen en voordelen van het gebruik van een gasbewakingsoplossing
- Ultradunne en zeer gevoelige reksensoren



